研究揭示染色质高级结构在细胞核内定位的调控机制
文章导读
染色质在细胞核内如何精准定位?传统技术只能“听见”相互作用,却看不见真实位置!中国科学院团队重磅突破,开发Radial-C技术,通过精准控制酶消化时间,首次绘制染色质径向定位图谱:核外围沉默异染色质“扎堆”,内部活跃结构如染色质环“沸腾”。更惊人的是,转录因子竟集体操控空间构象,相互作用本身成为定位“推手”。这项颠覆性发现,不仅破解染色体间互作的区室化密码,更为疾病与发育研究提供全新工具。想知细胞核内的空间革命?速读全文!
— 内容由好学术AI分析文章内容生成,仅供参考。
染色质在细胞核内的三维空间分布对基因表达调控、DNA复制和DNA损伤修复等生命基本活动至关重要。但是,传统的Hi-C技术仅能测量染色质片段间的相互作用频率,无法直接提供染色质形成的高级结构在细胞核内的物理定位信息,限制了科研人员对染色质空间组织形式及调控机制的理解。
近日,中国科学院北京基因组研究所(国家生物信息中心)研究人员开发了新型染色质构象捕获技术Radial-C,实现了对染色质相互作用沿细胞核径向轴(从核边缘到核中心)的精准定位,揭示了不同转录因子可“集体”调控染色质的径向分布。
该研究利用微球菌核酸酶在细胞核内的连续扩散特性,通过精确控制酶的扩散与消化时间(1分钟、5分钟、20分钟),构建了覆盖核边缘到核中心的染色质互作图谱。结合染色质互作频率,研究进一步构建了“径向得分”体系,将染色质高级结构定位到细胞核的径向轴上。研究发现,染色质高级结构沿细胞核径向轴呈现多样性——核外围区域富集沉默的异染色质结构,核内部区域富含活跃的染色质,如染色质环和核斑结构等。研究同时发现,染色质环的挤压方向与其内部区域的径向定位存在关联。
染色体间相互作用来源复杂,通常是Hi-C研究的“禁区”,其生物学功能鲜有报道。该研究通过“径向得分”,筛选出由径向上相互邻近的染色质形成的染色体间相互作用,发现它们与染色体内相互作用表现出几乎一致的活跃染色质/异染色质的区室化特征(A/B compartments),证明A/B区室分离是染色质的内在保守属性且与互作对象无关。
该研究通过急性干扰多种转录因子在染色质上的结合,发现染色质相互作用减弱通常伴随两个互作位点沿径向轴分离。这提示,染色质相互作用不仅仅是两个互作位点在细胞核内相互邻近的结果,其本身也能够作为作用力参与调控染色质在细胞核内的空间定位。
这一研究绘制了锚定细胞核物理坐标的染色质互作图谱,揭示了多个转录因子共同塑造染色质空间构象的调控机制,为探讨发育、疾病中基因组结构的变化提供了新的研究工具并奠定了理论基础。
8月29日,相关研究成果发表在《科学进展》(Science Advances)上。研究工作得到国家重点研发计划、国家自然科学基金、中国科学院战略性先导科技专项等的支持。
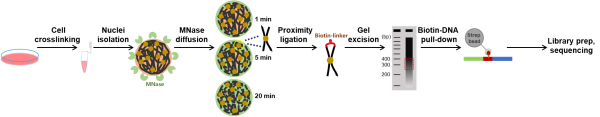
Radial-C方法的原理与基本流程
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...