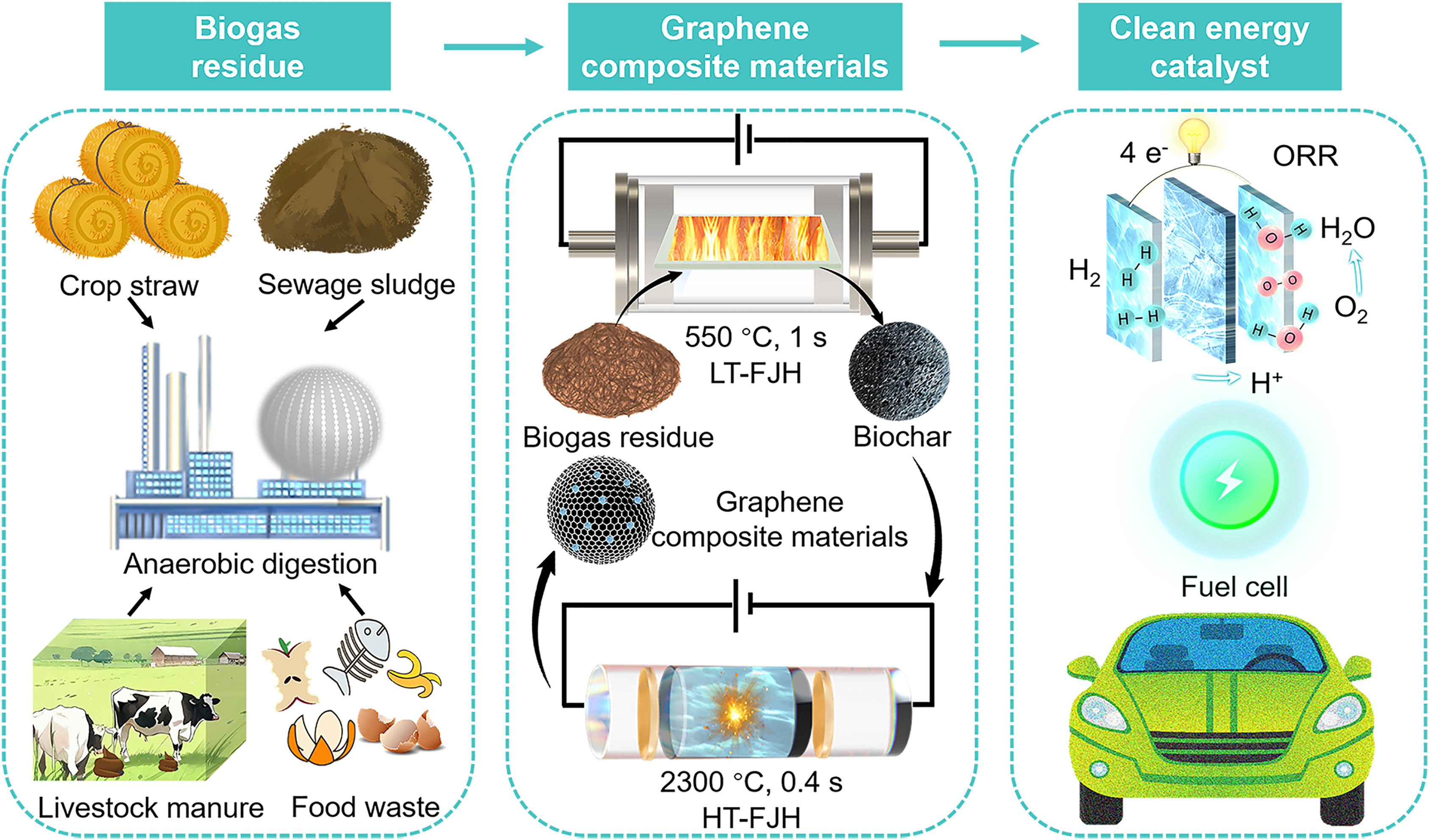
我国学者在AI驱动的活体蛋白质激活技术方面取得进展
文章导读
你是否想过,精准操控活体动物内的蛋白质功能,竟像按下“开关”一样简单?我国科学家突破性发明CAGE-Proxvivo技术,首次将机器学习与生物正交化学结合,实现小鼠体内蛋白质的通用型精准激活。告别紫外光穿透力差的难题,这项新技术不仅能特异性触发肿瘤细胞焦亡、激发抗肿瘤免疫,还可化学调控T细胞精准杀伤肿瘤。无需基因编辑,时空精度高,为免疫治疗与疾病机制研究带来革命性工具——一场精准医学的新变革正在开启。
— 内容由好学术AI分析文章内容生成,仅供参考。
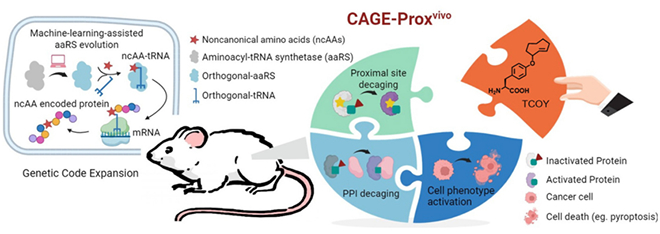
图 CAGE-Proxvivo技术通过机器学习辅助的”脱笼”化学实现活体蛋白质精准激活
在国家自然科学基金项目(批准号:21925701、22137001 和22321005)等资助下,北京大学陈鹏团队与王初团队在活体蛋白质功能调控技术方面取得进展,成功开发出机器学习辅助的活体蛋白质精准激活工具CAGE-Proxvivo。相关成果以“机器学习辅助的活体小鼠内通用蛋白质激活技术(Machine-Learning-Assisted Universal Protein Activation in Living Mice)”为题,于2025年5月27日发表于《细胞》(Cell)期刊。论文链接https://www.cell.com/cell/fulltext/S0092-8674(25)00517-3。
蛋白质功能的精准调控是揭示生命活动机制和疾病治疗的关键。2019年,上述两个团队就合作利用紫外光“脱笼”的酪氨酸(ONBY)为活细胞内的蛋白质安装了功能开关。这一被称为蛋白质“邻近脱笼”(CAGE-Prox)的策略具有很强的普适性,实现了活细胞内各种酶家族蛋白质的瞬时激活(Nature 2019, 569 (7757), 509-513)。然而,CAGE-Prox虽能实现高时空分辨的蛋白质调控,但其依赖紫外光激发的特性导致组织穿透性差,严重限制了在活体动物中的应用。当前生命科学研究亟需发展能够突破组织深度限制、实现精准可控的活体蛋白质功能调控新方法。
在本工作中,该两个团队继续合作,创新性地将机器学习算法应用于氨基酰-tRNA合成酶的设计,成功将化学保护的反式环辛烯-酪氨酸(TCOY)定点插入到精心设计的“脱笼位点”,通过四嗪类小分子触发的生物正交剪切反应实现蛋白质功能的原位激活和蛋白互作的精准调控。该技术突破性地实现了三大创新:首先,通过机器学习辅助在活体动物内建立了通用蛋白质激活平台,支持从基础研究到治疗干预的全链条应用;其次,成功实现肿瘤细胞特异性激活焦亡效应,激发强效抗肿瘤免疫应答;最后,开发出可化学激活的生物正交“门控”抗CD3抗体,实现化学调控的T细胞肿瘤靶向激活。
这项研究建立了“功能获得型”研究的全新技术范式:通过非天然氨基酸的定点插入实现蛋白质功能和蛋白-蛋白互作的精准时空调控,在不干扰生理状态的条件下,准确激活目标功能,可以避免传统基因编辑的不可逆的风险,也克服了光激活技术的组织穿透限制。该技术为动态解析蛋白质机制、发展精准诊疗策略提供了革命性工具,在免疫治疗、肿瘤研究等领域具有重大应用价值。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...