文章导读
如何精准操控基因编辑的时间与空间,避开早期致死陷阱?清华大学孟安明院士团队带来突破性工具!他们开发出可在斑马鱼中实现生殖细胞系特异、且受药物4-OHT诱导的时空双重控制基因编辑系统,有效避免传统方法导致的胚胎早期死亡和脱靶问题。该技术不仅成功揭示tbx16基因在原始生殖细胞迁移中的关键作用,还被验证可在小鼠胚胎中应用,具备跨物种潜力。一套可遗传的转基因品系为发育生物学研究提供了强大平台。想深入探索基因功能调控的幕后逻辑?这项工作不容错过。
— 内容由好学术AI分析文章内容生成,仅供参考。
基因编辑技术的迅速发展为解析复杂发育过程中的基因功能提供了重要工具。然而,相关技术在斑马鱼中的应用仍存在一些局限性,例如CRISPR/Cas9介导的全胚基因敲除往往导致胚胎早期死亡,而Cre/loxP条件性敲除系统则受限于loxP序列的种系敲入效率以及位点的限制等因素。上述问题在一定程度上阻碍了针对斑马鱼时空特异性发育调节机制的深入研究。
1月2日,清华大学生命科学学院孟安明院士课题组在《细胞生物学期刊》(Journal of Cell Biology)发表题为“通过4-OHT诱导型Cas9在整胚中实现时期及组织特异性基因编辑”(Stage- and tissue-specific gene editing using 4-OHT-inducible Cas9 in whole organism)的研究论文。该研究在斑马鱼中建立了一套生殖细胞系特异、可诱导的基因编辑系统,并证明通过4-OHT处理,可在不同发育阶段特异敲除生殖细胞系中的靶基因,实现时间特异性及组织特异性双重调控。此外,该诱导型Cas9蛋白在小鼠早期胚胎中同样可以实现条件性基因敲除,为跨物种研究提供了潜在工具。
研究团队基于4-羟基他莫昔芬(4-hydroxytamoxifen, 4-OHT)与突变型雌激素受体(estrogenreceptor, ER)构建了4-OHT诱导型Cas9蛋白nCas9ERT2,并在HEK293T细胞系中验证其在4-OHT处理后可诱导nCas9ERT2蛋白入核进行基因编辑。随后,研究人员构建了生殖细胞系特异表达诱导型Cas9蛋白转基因斑马鱼品系Tg(piwil1:nCas9ERT2-n3U)和泛表达gRNA转基因斑马鱼品系Tg(U6:gRNAs,cryaa:CFP)。
实验结果表明,该诱导型nCas9ERT2蛋白在斑马鱼胚胎原始生殖细胞(PGCs)及雌鱼卵母细胞中均成功响应4-OHT诱导,实现时间及组织特异性基因编辑。与传统的组织特异性基因编辑系统相比,该系统通过控制基因编辑的时间,有效避免了早期胚胎体细胞脱靶编辑,凸显该技术在胚胎早期PGCs研究中的重要价值。利用该系统,研究人员进一步探究了tbx16基因在PGC迁移过程中的功能,发现PGC特异敲除tbx16基因会影响PGC迁移,为理解tbx16在斑马鱼胚胎发育中的功能提供了新的实验证据,并拓展了对其参与斑马鱼PGC发育过程调控的认知。
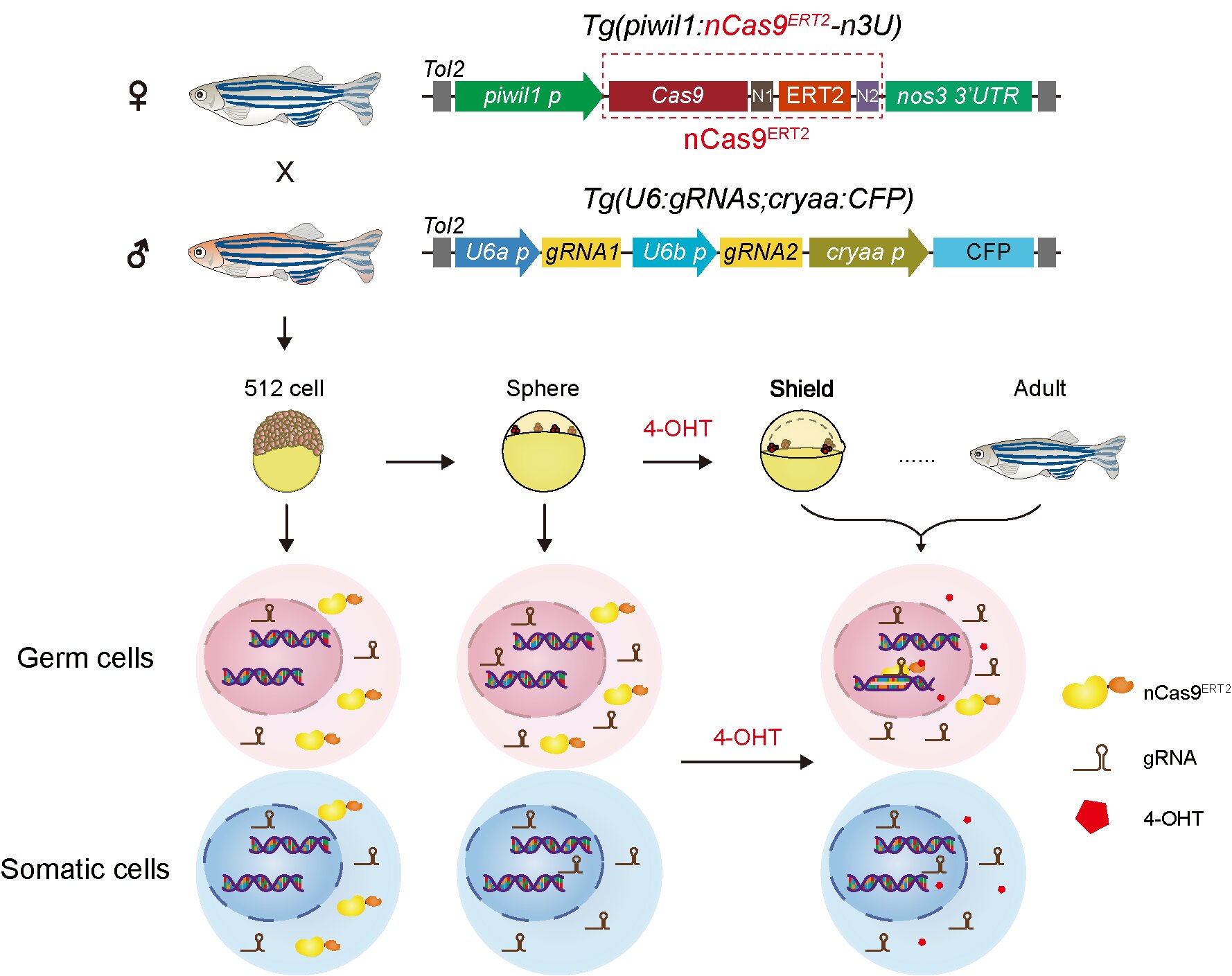
该时空特异性基因编辑系统及转基因斑马鱼品系模式图
清华大学生命科学学院副研究员吴小童和孟安明院士为论文通讯作者;2024届博士毕业生李雅琪,2025届博士毕业生张渭莹、危子航为论文共同第一作者。生命学院2019级博士生李晗、2022级博士生图尔荪江·艾则孜、博士后刘鑫与郑涛等为研究作出重要贡献;北京科技大学副教授幸岑璨参与了课题指导。研究得到国家自然科学基金、国家重点研发计划、清华-北大生命科学联合中心、膜生物学全国重点实验室等的资助。
论文链接:
https://doi.org/10.1083/jcb.202412216
供稿:生命学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















感觉还行 😊
听说这套系统已经在小鼠里跑通了,真是跨物种。
实验室的4-OHT配制总是搞得我头大。
前阵子我们实验室也用4-OHT做过基因敲除,操作起来还挺顺的。
这个转基因斑马鱼品系在后代维护上会不会出现表达不稳定的情况?
其实类似的诱导系统在斑马鱼中还有其他ER突变体可以尝试,可能更灵活。
4-OHT诱导的Cas9真是解决了早期胚胎脱靶的难题,值得一试。
这个系统挺实用的。