文章导读
一种致命病毒如何入侵细胞?清华团队最新研究捕捉到了关键“瞬间”。他们首次以近原子分辨率看清了裂谷热病毒表面糖蛋白的精确组装形态——一个独特的六元环结构。更重要的是,研究揭示了高效中和抗体如何像一把“分子锁”,将这个六元环牢牢锁定,从而阻止病毒与细胞融合。这项发表于《美国国家科学院院刊》的突破,为开发对抗这种高危病原体的疫苗和特效药物,提供了至关重要的结构蓝图。
— 内容由好学术AI分析文章内容生成,仅供参考。
裂谷热病毒(Rift valley fever virus, RVFV)是一种由节肢动物传播的致命性人畜共患病毒,对人类健康和畜牧业构成严重威胁,已被流行病防范创新联盟(CEPI)列为优先发展有效疫苗的病原体之一。裂谷热病毒表面糖蛋白Gn和Gc蛋白组装形成六元环及五元环结构,这些结构进一步组装形成位于病毒囊膜外且具有二十面体对称性的糖蛋白层。裂谷热病毒糖蛋白在病毒入侵过程中起关键作用,但其组装的具体分子机制仍有待进一步解析。
12月16日,清华大学基础医学院向烨课题组在《美国国家科学院院刊》(Proceedings of the National Academy of Sciences of the United States of America, PNAS)发表了题为“裂谷热病毒囊膜蛋白与高效中和抗体复合物的冷冻电镜结构”(Cryo-EM structure of the Rift Valley fever virus envelope protein in complex with a potent neutralization antibody)的研究论文,首次获得了裂谷热病毒GnGc六元环高分辨率冷冻电镜结构,解析了该六元环组装的关键结构基础,同时阐明了一种高效抗体RVFV-140的中和机制。
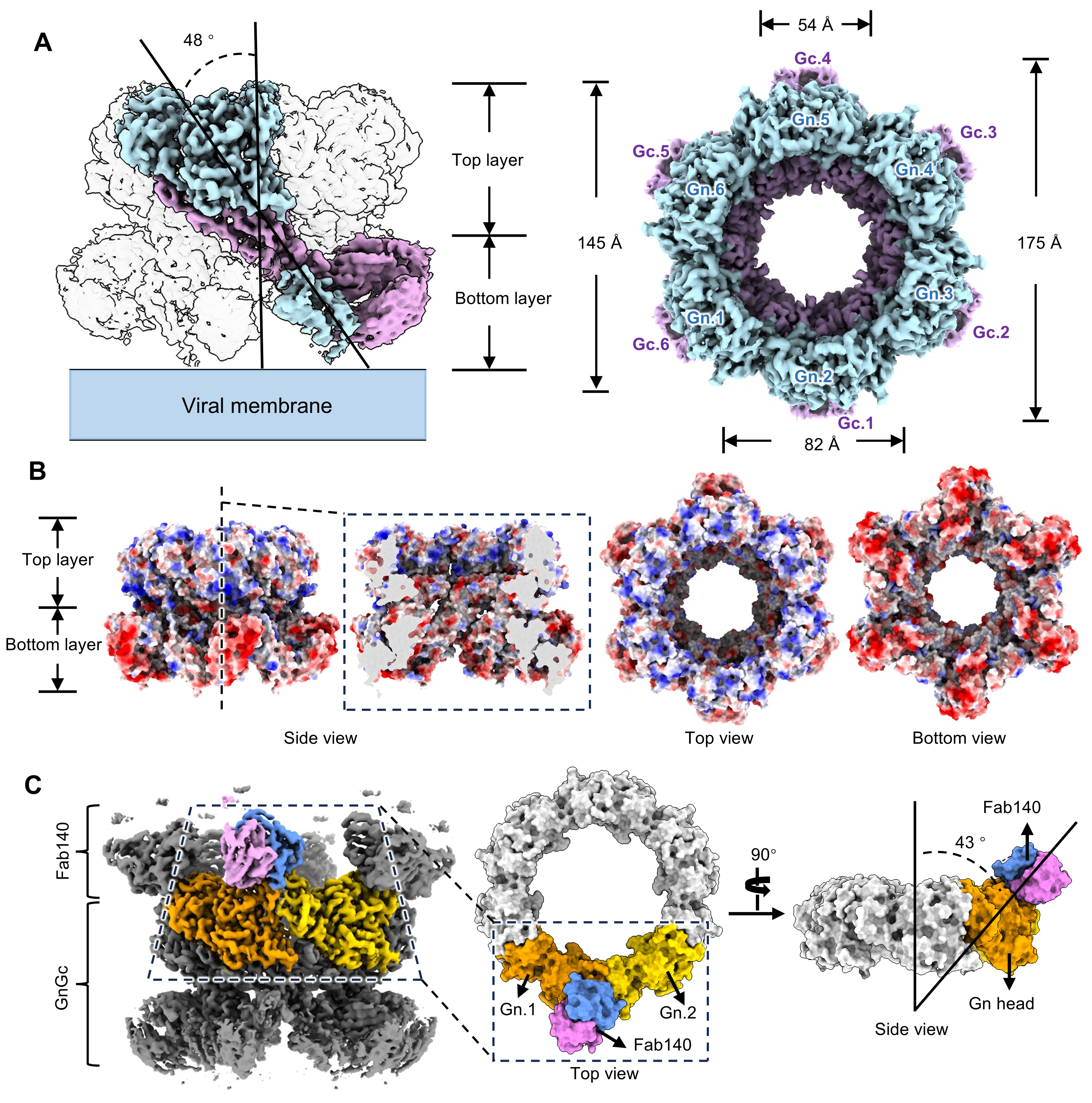
研究团队通过共表达GnGc与一种识别结构表位的中和性抗体RVFV-140的Fab区(Fab140),成功获得了可形成稳定GnGc六元环结构的复合物,并利用冷冻电镜技术解析了其近原子分辨率结构。RVFV GnGc-Fab140复合物由六个GnGc异二聚体和六个Fab140组成。其中GnGc异二聚体结构与此前报道的Gn、Gc单体结构具有显著差异。六个GnGc异二聚体以倾斜方式围绕中心轴分布,形成一个由上下两层组成且每层直径不同的六元环状结构。其中,上层主要由Gn的头部(结构域A、B和β片层区)构成,下层则由Gn的结构域C及Gc的结构域I和III共同组成。每个Fab140结合在六元环上层两个相邻Gn头部之间,对稳定GnGc六元环结构起到了关键作用。GnGc六元环结构形成的过程中,四个位于Gn分子间作用界面的loop区发生剧烈构象改变。
裂谷热病毒入侵过程中,其糖蛋白GnGc需要从融合前的六元环构象转变为融合后的Gc三聚体构象。该过程依赖于内体中pH值的改变,且包含两个关键步骤:Gn的脱离和Gc变构与重新组装过程。而一旦RVFV-140结合在GnGc六元环的相邻Gn间,就会将GnGc复合物锁定为融合前的六元环构象,使其难以向融合后构象转变,从而抑制膜融合过程的发生。
综上所述,该研究揭示了裂谷热病毒GnGc六元环组装的分子机制,同时还阐述了裂谷热病毒中和抗体RVFV-140发挥作用的分子机制,为裂谷热病毒疫苗及治疗性抗体的开发提供了重要结构学基础及理论依据。
清华大学基础医学院教授,清华-北大生命科学联合中心、北京生物结构前沿研究中心、山西医科大学-清华大学前沿医学研究中心研究员向烨为该论文通讯作者,向烨课题组2024届博士毕业生张琳婧、2022级博士生孟凯闻为论文共同第一作者。清华大学中国蛋白质科学中心(北京分中心)为研究提供了设施支持。研究得到山西医科大学-清华大学医学院前沿医学协同创新中心、中国科学技术部、清华-北大生命科学联合中心、北京生物结构前沿研究中心的资助。
论文链接:
www.pnas.org/doi/10.1073/pnas.2514862122
供稿:基础医学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















这类结构学研究对疫苗设计真有帮助,但希望别被寄予过高期待,转化需要时间。
哈哈,蛋白学家们又要熬夜画结构模型了,期待后续功能验证和动物实验的结果。
请问RVFV-140对不同毒株的中和广谱性如何?有没有相关体内数据?🤔
看到清华团队发PNAS,骄傲!不过从论文到临床还差好多步,别太急于乐观。
这种把融合前构象“锁死”的抗体思路棒极了,有望成为治疗的新方向。
冷冻电镜能拍到近原子分辨率真厉害,GnGc六元环的构象变化描述得很清楚。
这个结构图太酷了,希望能尽快转化成疫苗或抗体药物,给科研团队点个赞!