研究发现限制人多能干细胞发育潜能机制
文章导读
科学家发现限制人胚胎干细胞发育潜能的"刹车"机制!中国科学院研究团队揭示,去泛素化酶USP7通过调控mTOR活性,阻止干细胞向胚外组织发育。突破性发现:敲除USP7后,人胚胎干细胞竟获得了模拟早期胚胎发育、形成复杂胚胎样结构的能力,为优化体外胚胎培养体系开辟新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
哺乳动物胚胎发育起始于受精卵,随后经历连续的谱系分化,最终形成完整个体。在早期胚胎发育中,细胞第一次命运分离发生在囊胚期,由全能性细胞分化为胚胎内的内细胞团(ICM)和胚外的滋养外胚层(TE)。ICM细胞保留分化为机体所有细胞类型的潜能,但来源于ICM的体外培养人胚胎干细胞属于多能性细胞,仅展示有限的胚外组织潜能。这种从全能性向多能性的转变标志着细胞谱系发育潜能的限制,其内在决定机制尚不明确。
近期,中国科学院广州生物医药与健康研究院研究团队,揭示了限制人多能干细胞发育潜能的关键因子——去泛素化酶USP7,并阐释其通过去除mTOR蛋白上非经典K63多泛素化修饰,从而调控mTOR活性的机制。
研究团队发现,USP7缺陷的人胚胎干细胞表现出较强的单细胞存活能力。将这些细胞在拟胚体培养基中培养,可形成拟胚体结构。当它们被转入不含特定形态发生素的囊胚培养基后,可自发形成类似囊胚的结构,并表达胚外谱系标志物。相比之下,野生型人胚胎干细胞无法呈现类似囊胚的结构,同样不表达胚外谱系标志物。
团队将这些类囊胚结构的聚集体进行贴壁培养,发现其可产生胚外的滋养层亚类细胞——绒毛外滋养层细胞和合体滋养层细胞,同时,还形成了卵黄囊腔和羊膜腔典型胚胎腔结构。结果表明,USP7就像人胚胎干细胞发育潜能的“刹车”,限制了它向胚外组织发育,即敲除USP7解除了人胚胎干细胞的胚外谱系发育限制,并使其具备了模拟早期植入后胚胎发育、形成复杂胚胎样结构的能力。
团队进一步探索了USP7限制胚外潜能作用机制,发现USP7敲除后,mTOR蛋白上的非经典K63泛素链无法被去除,从而导致mTOR蛋白磷酸化水平上升,mTOR信号通路活性增强。这使得细胞内蛋白翻译水平上调,尤其是多能性标志物的蛋白水平增加,最终导致人胚胎干细胞的胚外谱系限制被解除。这表明,USP7通过去除非经典的K63多泛素化而减弱mTOR活性,进而限制人胚胎干细胞的胚外发育潜能。
该研究鉴定了USP7介导的非经典K63泛素化去除关键内源机制,阐明了其如何限制人胚胎干细胞的胚外谱系发育潜能,表明了蛋白翻译控制在早期细胞命运决定中发挥着重要作用。该发现揭示了细胞发育潜能限制的多维调控,有助于优化模拟体外胚胎早期发育过程的培养体系。
相关研究成果发表在The Innovation Life上。研究工作得到国家自然科学基金委员会等的支持。
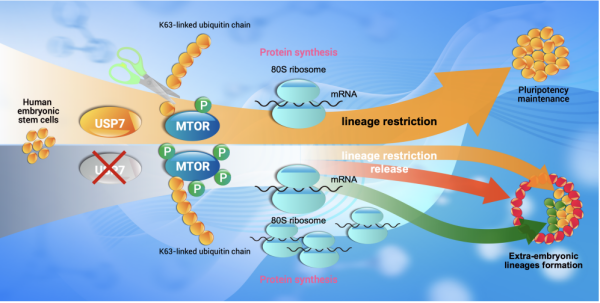
USP7通过调节mTOR信号通路调节胚胎干细胞发育潜能
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















这研究要是能优化培养体系,对再生医学简直是大利好!😊
说白了就是翻译水平一上去,细胞命运就松绑了?有点意思
论文发The Innovation Life,中科院团队稳啊!吃瓜等后续应用~
mTOR通路又立功了…感觉这个信号轴真是发育里的万金油
敲除USP7就能模拟囊胚?那以后人造胚胎是不是更容易了🤔
终于有人搞清楚多能干细胞为啥不能变胚外组织了,厉害!
USP7原来是“刹车”啊,这比喻太形象了!👍