文章导读
你是否知道,基因组中“沉默”的非编码区,竟藏着结直肠癌爆发的关键开关?武汉大学缪小平/田剑波团队破译了肿瘤演进的表观遗传“动态密码”,首次绘制出中国人群结直肠癌全过程调控图谱。通过CRISPRi功能筛选,锁定185个促癌“推手”与80个抑癌“刹车”元件,并发现功能性遗传位点rs10871066能“一键切换”基因表达命运——从沉默子变增强子,显著提升患癌风险。更重磅的是,团队据此构建新型功能性PRS模型,预测效能远超传统方法,为无症状人群精准识别高风险个体提供高效新工具,或将重塑早筛格局。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员樊杰)近日,武汉大学公共卫生学院和泰康生命医学中心缪小平/田剑波教授团队,在Nature Cancer在线发表题为“Characterization of cis-regulatory elements and functional variants in colorectal cancer using epigenomics and CRISPRi screenings”的原创研究论文。
近年来,随着GWAS的推进,研究者已识别出超过200个与结直肠癌(Colorectal cancer)相关的遗传易感位点,为CRC高危人群的识别和个体化预防提供了重要线索。然而,这些研究发现的遗传易感位点直接精准应用于医学转化实践仍面临一定的挑战。绝大多数易感位点分布于基因组非编码区域,其统计关联性背后的具体生物学作用机制亟待阐明。非编码区富集着诸如启动子、增强子、绝缘子、沉默子等多种顺式调控元件(Cis-Regulatory Element, CRE)。位于CRE区域的遗传变异,能够干扰转录因子的正常结合,改变调控元件的活性状态及染色质空间构象,最终导致靶基因表达失调并影响疾病易感性。
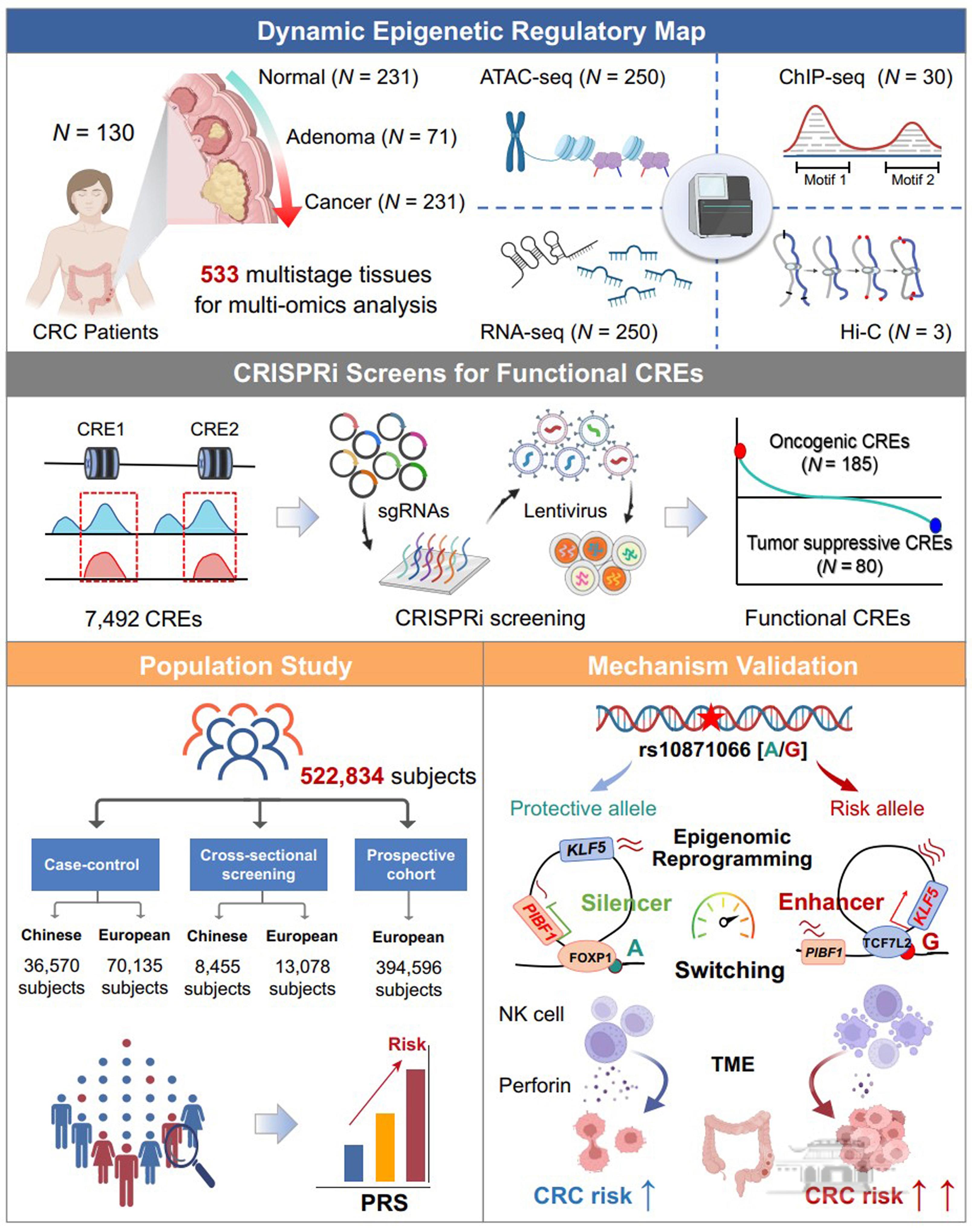
为解决上述问题,研究团队基于130例CRC患者的533份多阶段组织样本(涵盖正常组织、进展期腺瘤及癌组织),整合ATAC、Hi-C等多模态组学数据,首次构建了CRC动态演进过程的染色质遗传调控元件CREs图谱,共鉴定了7492个肿瘤性阶段变化的CREs。进一步采用CRISPRi技术对这7492个活性CRE进行功能筛选,共鉴定出185个促癌CREs和80个抑制癌细胞增殖的CREs。分析发现功能评分越强的CRE区域,其内部的遗传位点对CRC遗传易感性贡献越高,其在GWAS富集程度是非功能性CREs的3.5倍。GWAS研究发现的易感位点已被广泛应用于多基因风险评分(Polygenic Risk Score, PRS)。然而,基于传统GWAS位点构建的PRS在预测性能上仍存在局限,尤其难以全面涵盖与疾病功能密切相关的遗传变异。为此,本研究基于功能CRE内遗传变异构建了一种功能性PRS模型,并在全球多种族、大规模人群中(病例-对照人群、结直肠癌筛查人群和前瞻性队列人群)评估其风险预测效能和高风险人群识别能力。结果发现与传统GWAS统计学关联位点衍生的PRS相比,功能性PRS在风险分层和新发病例预测方面均表现出更优的性能,有望为结直肠癌镜检(金标准)前对普通人群进行高风险分层提供了一种更为便捷、可行的补充策略。最后,研究团队对功能评分最强的CRE元件及其功能性遗传变异rs10871066进行了流行病学人群验证和生物学功能解析。经过全球多中心、跨种族人群研究揭示该位点G等位基因突变显著增加了个体罹患癌前病变及结直肠癌(OR=1.27,P=1.03×10−13)风险;在功能机制层面,CRE调控位点-rs10871066具有双向功能调控作用,转录因子FOXP1和TCF7L2分别与位点的A和G等位基因特异性结合,从而介导该元件从“沉默子”转变为“增强子”功能角色转换,其功能由抑制目标基因PIBF1的表达转换为促进目标基因KLF5的表达。
综上所述,本研究整合多模态多组学数据和功能基因组技术构建了中国人CRC动态演变全过程的表观遗传调控图谱,系统性鉴定CRC功能性调控元件,为探索肿瘤发生机制提供了可靠方法与创新视角;基于功能调控位点构建的PRS模型,突破了传统遗传风险预测的瓶颈,为中国人群CRC精准早筛提供了新工具。研究还揭示了“沉默子-增强子”转换这一新型表观遗传重编程机制,为CRC靶向干预提供了潜在遗传分子靶点。研究成果深化了对结直肠癌遗传易感新机制的认识,为实现“健康中国2030”肿瘤早筛提供了关键技术支撑。
论文链接:https://www.nature.com/articles/s43018-025-01031-z#Ack1
(供图:公共卫生学院 编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...