脑钙化关键蛋白XPR1的活性调控机制获揭示
文章导读
你是否想过,脑内钙化竟与一种“分子钥匙”失控有关?人体唯一已知的磷酸盐外排蛋白XPR1,一旦失灵,就会导致脑钙化、肿瘤甚至血栓。但它是如何被精准调控的,长久以来成谜。现在,中外科学家联手破解了XPR1的“钥匙-锁”激活机制和“敲-吻-踢”磷酸外排过程,首次揭示InsP8如何解除多重抑制,让XPR1恢复活性,并阐明致病突变的根源。这项突破不仅解开多年科学谜题,更将为脑钙化等疾病的治疗打开全新通路。
— 内容由好学术AI分析文章内容生成,仅供参考。
磷是维持人体生命活动的必需元素,在核酸构成、能量代谢、信号传导及骨骼发育等生理过程中发挥关键作用。细胞内磷酸盐的摄入对生命活动至关重要,但过量的磷酸盐积累会与钙、镁、铁等离子沉积,带来细胞和组织毒性,需要外排机制及时平衡。
XPR1是目前人体唯一已知的磷酸盐外排蛋白,其功能异常与脑钙化、血栓形成、肿瘤发生等疾病相关。在原发性基底节脑钙化症中,XPR1功能失调导致磷酸盐外排障碍,进而形成钙磷沉积,诱发神经系统病变。在细胞内,XPR1的功能可被磷酸盐浓度指示分子焦磷酸肌醇InsP8激活。同时,支架蛋白KIDINS220能够与XPR1形成复合物调控磷酸盐的外排。但是,KIDINS220和InsP8调控XPR1功能的分子机制并不清晰,制约了XPR1功能失调引起的脑钙化等疾病发生机理的研究。
近日,中国科学院上海有机化学研究所张一小课题组联合澳大利亚国立大学Ben Corry课题组、上海科技大学孙亚东课题组、美国国立环境健康科学研究所Stephen Shears课题组,通过结构解析、功能研究、计算模拟等手段,揭示了XPR1一种精细的key-to-locks活性调控方式,以及独特的knock-kiss-kick磷酸转运外排机制,阐明了原发性脑钙化相关突变的致病机理,发现了磷酸外排同源蛋白XPR1、PXo、PHO1在进化上的保守性和差异性。
该研究描绘了XPR1的逐步激活过程,并提出了两个新模型——key-to-locks揭示了InsP8如何解除KIDINS220及XPR1自身施加的多重抑制,knock–kiss–kick描述了磷酸盐的外排过程。这些发现为理解人类磷酸盐稳态奠定了分子基础,并为脑钙化、肿瘤等疾病的致病机理研究及潜在干预策略研发开辟了新方向。
相关研究成果发表在《分子细胞》(Molecular Cell)上。研究工作得到科技创新2030-“脑科学与类脑研究”重大项目和国家自然科学基金等的支持。
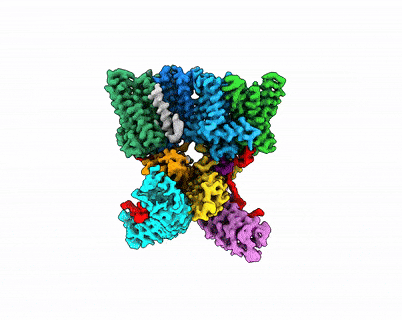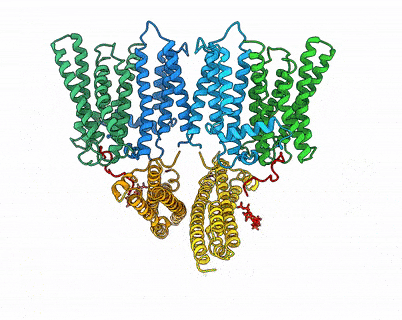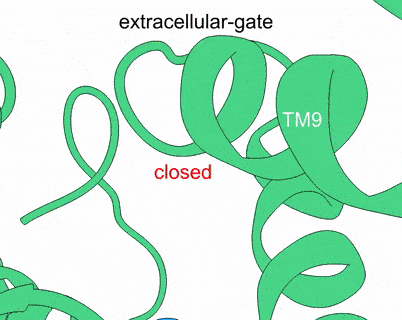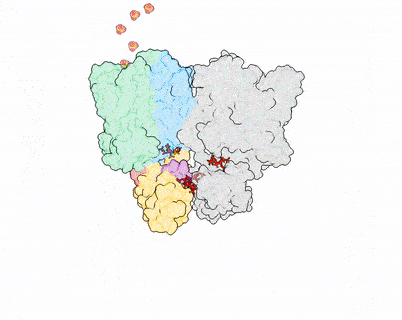
XPR1–KIDINS220复合物结构及InsP8激活XPR1的全构象变化过程
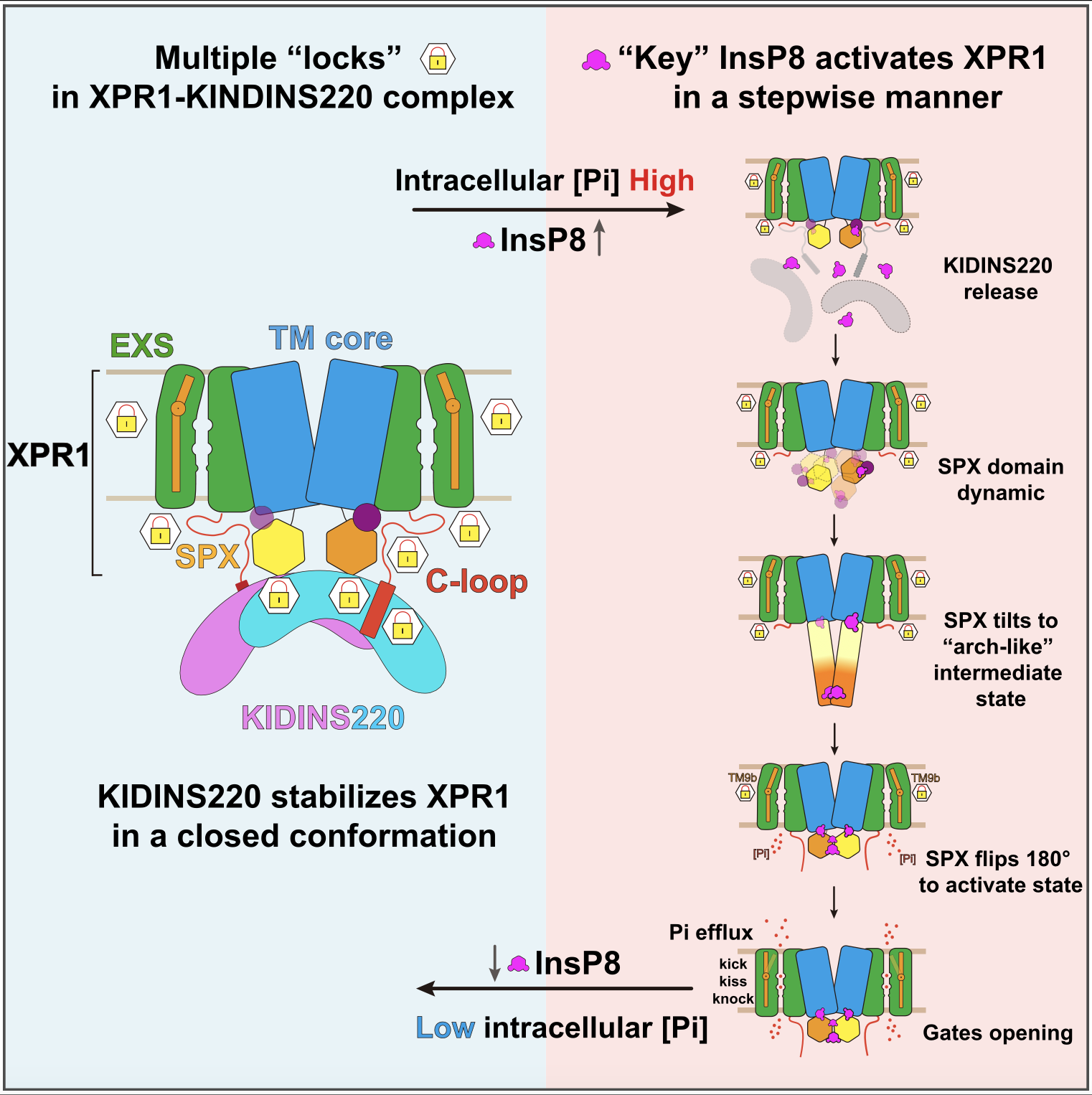
KIDINS220和InsP8调控XPR1磷酸盐转运活性模型
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...