文章导读
你是否还在为作物抗病育种的瓶颈发愁——明明投入大量资源筛选抗病基因,却总在产量和抗性间顾此失彼?大多数人误以为表观遗传调控仅用于稳定基因组,殊不知RdDM通路在大豆中暗藏致命盲区:它竟系统性压制着防御基因的激活。北大陈雪梅团队通过多组学实测发现,敲低Pol IV/V后植株对疫霉菌抗性飙升,这个被长期忽略的"免疫刹车"机制,直接导致传统育种浪费了数年时间。但更关键的是,如何精准松开这个刹车而不触发生长灾难?答案藏在小RNA的交叉调控里,它可能让抗病改良成本直降50%,可99%的实验室还在用老方法白烧经费。
— 内容由好学术AI分析文章内容生成,仅供参考。
小RNA是几乎所有真核生物中不可或缺的调控因子。在植物中,21—24个核苷酸长度的小RNA通过转录或转录后水平的沉默机制,精细调控基因表达、维持基因组稳定,并参与生长发育和环境应答。其中,RNA介导的DNA甲基化(RNA-directed DNA methylation, RdDM)通路是植物特有的重要表观遗传调控机制,主要依赖24-nt siRNA以及两种植物特有的RNA聚合酶,即Pol IV和Pol V来发挥作用。
在经典模式植物拟南芥中,RdDM通路的核心机制已被系统阐明:Pol IV负责产生24-nt siRNA的前体,Pol V则通过生成“支架RNA”将siRNA引导至同源基因位点,触发DNA甲基化,从而实现对转座子和部分基因的转录沉默。然而,这一通路在农作物大豆中的分子功能与生物学意义,尤其是其与植物免疫之间的关系,人们仍知之甚少。
2026年2月9日,北京大学讲席教授、生命科学学院院长、核糖核酸北京研究中心主任陈雪梅研究组在植物学知名期刊Plant Cell上发表题为“Soybean RNA polymerases IV and V repress defense response genes and plant immunity”的研究论文。该研究发现,除在RdDM中的保守经典功能之外,大豆中Pol IV和Pol V还承担着一个此前被低估的重要角色——它们在整体上抑制植物防御相关基因的表达,使大豆在生长与免疫之间维持一种可塑的平衡状态。
大豆拥有一个体量庞大、转座子高度富集的基因组,RdDM被认为对其基因组稳定性至关重要。该研究通过RNA干扰技术,在大豆中分别敲低了Pol IV、Pol V各自的核心特有大亚基及其第二大共享亚基,并对这些材料的小RNA组、转录组和DNA甲基组进行了多组学系统分析。结果表明,大豆中Pol IV和Pol V在RdDM中的经典功能与拟南芥高度保守:Pol IV产生24-nt siRNA,并在Pol V的参与下介导DNA甲基化。
更有趣的是,研究发现Pol IV和Pol V还承担着一个此前被低估的重要角色——它们在整体上抑制植物防御相关基因的表达。在Pol IV或Pol V被敲低后,一些防御响应基因被解除沉默,其中部分基因的转录本进一步被导入RNA干扰通路,产生21—22nt的siRNA,提示RdDM与其他小RNA通路之间存在交叉调控。
在生理层面,这种“解除沉默”带来了明确的表型后果:Pol IV和Pol V敲低的大豆植株对疫霉菌Phytophthora sojae表现出更强的抗性。这一结果表明,Pol IV/Pol V介导的基因沉默并非单纯“关闭有害元件”,而是在生长与免疫之间维持一种可塑的平衡状态。该研究揭示了RdDM通路在作物免疫调控中的新功能,有望拓展人们对植物表观遗传调控网络的认识,也为作物抗病改良提供了潜在新思路:通过精细调控“沉默机制”,或许可以在不显著牺牲生长的前提下,增强植物的抗病能力。

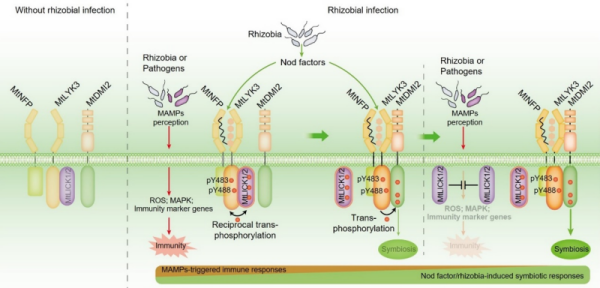
图1 Pol IV/V介导的RdDM调控大豆抗病免疫的模型示意图
在野生型大豆中,Pol IV和Pol V通过RdDM通路在防御响应基因位点建立DNA甲基化维持其转录沉默状态,植株整体免疫水平较低、对病原菌易感。敲低Pol IV/V后,防御基因解除沉默并被激活,从而增强植株对病原菌的抗性。有趣的是,这些激活的防御基因的转录本进一步被导入RNA干扰通路,产生21—22nt的siRNA。
陈雪梅为本文的通讯作者,助理研究员王旭峰、美国加州大学河滨分校生物信息中心Brandon H. Le和博士后Ye Xu为论文共同第一作者。该研究获国家自然科学基金、基因功能研究与操控全国重点实验室及中央引导地方科技发展计划等项目的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















研究组挺厉害啊,北大生科果然强
之前做植物实验也遇到过类似现象🤔
这个Pol IV/V敲低后抗性增强的原理没太看懂
大豆抗病研究挺有意思的,希望早日应用