研究揭示原纤维蛋白-5调控茄尼基焦磷酸合酶催化活性的分子机制
文章导读
你是否想过,一片绿叶中的分子机器竟藏着新型除草剂的钥匙?一项最新研究揭秘了植物中一个关键酶——茄尼基焦磷酸合酶(SPS)如何被“分子开关”原纤维蛋白-5(FBN5)精准调控的全过程。通过晶体结构与冷冻电镜技术,科学家首次揭示FBN5能诱导SPS从交替催化转变为同步催化,大幅提升反应效率。更意外的是,治疗骨质疏松的药物唑来膦酸竟可强力抑制SPS活性,展现出广谱除草潜力。这项发表于《自然-植物》的成果,不仅破解了光合作用关键步骤的调控之谜,更为设计新一代高效除草剂提供了全新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
茄尼基焦磷酸合酶(SPS)是光合作用电子载体质体醌生物合成途径中的关键酶,也是近年来新发现的一种除草剂作用靶标。有研究表明,原纤维蛋白-5(FBN5)或通过调控SPS的酶催化活性参与质体醌的生物合成。然而,学界对FBN5与SPS相互作用及其调控SPS催化活性的分子机制尚不明晰。
2026年1月5日,中国科学院生物物理研究所等研究团队,利用生物化学、结构生物学、计算模拟等多种手段,系统阐明了水稻中OsSPS3的催化机制及其与OsFBN5相互作用的分子机制,为理解质体醌生物合成的调控机制提供了科学依据。
研究团队解析了OsSPS3蛋白与多种不同配体结合的高分辨率晶体结构,其非对称的二聚体结构表明,OsSPS3或通过两个单体之间的构象转换来交替实现其催化功能。研究团队综合运用多种实验手段证实,OsFBN5与叶绿体定位的OsSPS3之间存在很强的特异性直接相互作用。同时,研究团队通过冷冻电镜技术,解析了apo状态及与底物类似物GGSPP结合的OsSPS3-FBN5复合体高分辨率结构。研究发现,复合体状态下,OsFBN5的结合诱导OsSPS3单体中关键loop区域发生由开放到闭合的构象转变。这一构象变化促使两个OsSPS3单体均形成了完整且对称的底物结合口袋,从而使两个催化中心实现同步的酶促反应。
基于上述发现,研究团队提出了OsFBN5诱导OsSPS3从交替催化转变为同步催化的分子模型,并通过设计OsSPS3异源二聚体(OsSPS3WT/AA),验证了OsFBN5可通过结合作用,诱导原本非活性的亚基构象发生转变,使其转化为活性状态,从而实现二聚体中两个催化中心的同步催化。这一机制解释了OsFBN5对OsSPS3功能的调控方式,为OsFBN5可明显提升整体催化效率提供了直接的实验证据,也为学界深入理解光合作用相关酶的催化机制及其相关分子育种提供了重要的科学依据。
研究团队进一步通过虚拟筛选发现,临床用于治疗骨质疏松的药物唑来膦酸(ZOL)可有效结合在SPS催化反应中心口袋,并通过体外酶活实验、晶体结构解析等揭示了ZOL作为竞争型抑制剂的结合模式。温室除草活性筛选表明,ZOL表现出广谱高效除草活性,可作为除草剂先导化合物供进一步研究。该研究为研制新型SPS除草剂奠定了基础。
相关研究成果发表在《自然-植物》(Nature Plants)上。研究工作得到国家自然科学基金委员会、科学技术部等的支持。
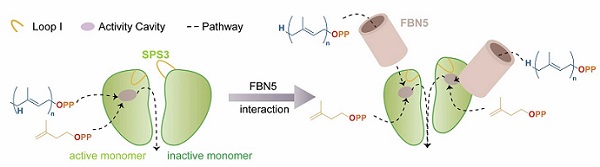
FBN5诱导SPS3从交替催化转变为同步催化的分子模型
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















前几天做叶绿体蛋白互作实验,差点把SPS当成背景蛋白忽略掉,现在看真是踩坑边缘了。
FBN5结合后两个单体都活化了?那如果缺失FBN5是不是就只剩一半效率?
说真的,从交替到同步催化这个机制挺巧妙的,植物里居然玩出这种精密操作。
OsSPS3的构象转变细节有人能再讲讲吗?这个loop区域具体是哪一段?
之前一直以为SPS是独立工作的,没想到还有搭档配合。
这研究有点东西,FBN5还能这么调控酶?👍