科研人员开发出超声激活型聚多肽纳米佐剂
文章导读
如何让免疫治疗精准狙击肿瘤,同时避免伤及健康组织?中国科学院上海药物所团队带来突破性答案:一种可被超声激活的聚多肽纳米佐剂。它能在超声引导下,精准于淋巴结内释放免疫“启动信号”,高效激活树突细胞,显著增强抗肿瘤T细胞应答,同时规避传统佐剂易引发的系统性免疫毒性。该平台不仅能普适性递送肿瘤新抗原,还在肝癌模型中展现出强大抑瘤效果,为下一代智能疫苗递送系统提供全新路径。这项发表于《自然-通讯》的研究,或将改写癌症免疫治疗的游戏规则。
— 内容由好学术AI分析文章内容生成,仅供参考。
免疫佐剂是一类能激活特定先天免疫信号通路的物质,如Toll样受体(TLR)激动剂、干扰素刺激因子(STING)激动剂等。当免疫佐剂与肿瘤抗原联合使用时,能有效刺激树突细胞熟化、促进抗原交叉呈递与T细胞激活,且免疫佐剂还具有重塑肿瘤免疫、抑制微环境的能力,其通过重编程M2型巨噬细胞及限制髓源性抑制细胞功能,来增强细胞毒性T淋巴细胞浸润与杀伤。然而,传统制剂形式的免疫佐剂在系统给药时,通常面临非特异性组织分布与脱靶激活问题,导致剂量限制性免疫毒性产生,阻碍其进一步临床转化与应用。
近日,中国科学院上海药物研究所研究团队,构建了超声激活型聚多肽纳米佐剂平台。该平台在超声刺激条件下,能够时空可控地调节淋巴结内先天免疫反应激活,并可普适性地高效递送肿瘤特异性新生抗原多肽,在体内诱导强烈且特异的抗肿瘤T细胞免疫应答。
研究团队将临床批准使用的声敏剂(血卟啉单甲醚,HMME)共价偶联至生物可降解聚多肽骨架上,来构建声敏化聚多肽。研究显示,其在超声刺激条件下,能够精准产生机械效应与氧化效应,以协同诱导树突细胞熟化与先天免疫反应激活,即具有超声激活型免疫佐剂活性。同时,研究团队通过表面糖配体修饰与电荷修饰策略,筛选优化了聚多肽纳米佐剂处方,使其具备主动且高效靶向淋巴结内树突细胞的能力。相比传统TLR激动剂或STING激动剂,聚多肽纳米佐剂在联合超声刺激后(SONA+US),可有效提高淋巴结内先天免疫反应的激活水平,并规避系统免疫毒性,即外周细胞因子风暴产生。该超声激活型免疫佐剂策略可进一步用于增强肿瘤新生抗原多肽疫苗治疗。研究表明,包载有肝癌特异性新抗原多肽的纳米佐剂与超声刺激联合治疗时,能够诱导强烈且安全的抗肿瘤T细胞免疫应答,显著抑制小鼠原位肝脏肿瘤生长,并延长荷瘤小鼠生存期。
这一研究展示了将外源物理刺激转译为精准免疫信号的治疗原型,为后续开发刺激响应型的精准免疫佐剂策略提供了重要参考。
相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院、上海市等的支持。
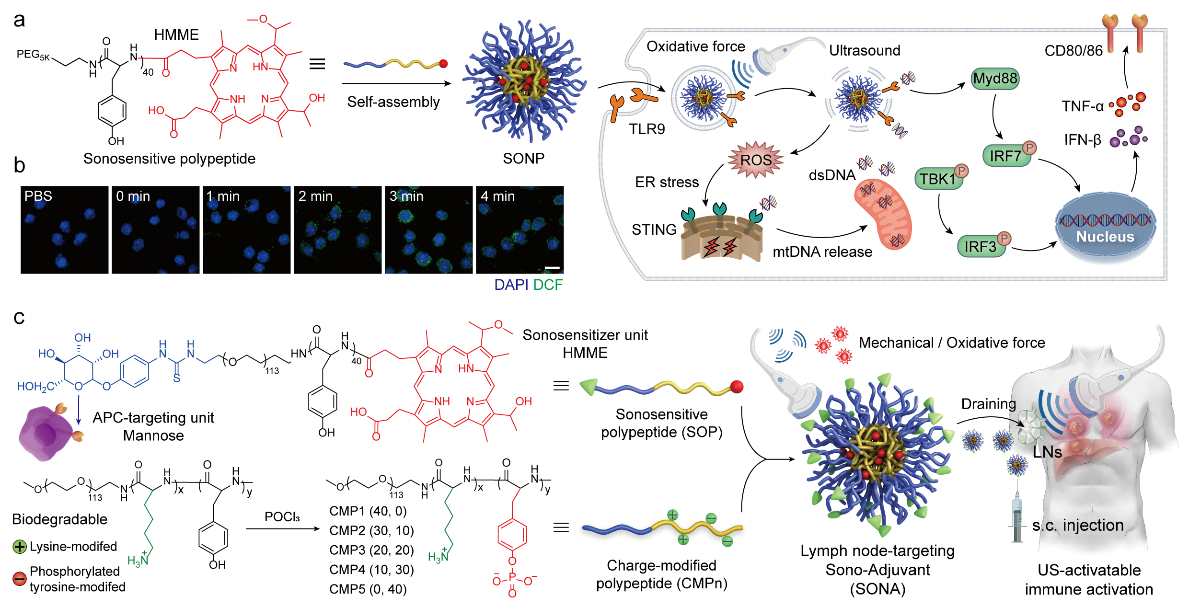
超声激活型聚多肽纳米佐剂增强肿瘤新抗原疫苗治疗示意图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。

















如果把聚多肽骨架上的糖配体换成其他靶向分子,能否进一步提升对不同肿瘤的特异性?还有没有数据显示不同超声频率对免疫激活的影响?
听说这项技术已经在小鼠肝癌模型里延长了生存期,真是让人期待后面能否上临床。👍
我之前做过类似的声敏剂实验,配合超声时确实能提升树突细胞活化,操作上要注意超声功率。
相比传统TLR激动剂,这种超声激活方式真的能减少全身细胞因子风暴,安全性提升明显。
这个纳米佐剂在人体里会不会被快速清除?如果清除太快,免疫效果还能保持吗?
超声装置配合起来挺麻烦的。
看起来靠谱。
挺有意思的创新。