mRNA疫苗递送研究取得进展
文章导读
你是否好奇mRNA疫苗进入人体后究竟去了哪里?传统递送系统常被肝脏“误捕”,效率低且存隐患。现在,中国科学院团队突破性地开发出一种“自带定位信号”的含氟脂质纳米颗粒(FLNP),不仅可高效递送mRNA,更能在活体中被19F磁共振实时追踪,实现全过程可视化。研究首次清晰揭示:载体到达何处、抗原如何表达、免疫细胞怎样被激活,构建出完整的体内作用链条。这项兼具精准递送与无创监测双重优势的新技术,为疫苗设计与核酸药物研发提供了强大工具,相关成果已发表于《美国科学院院刊》。
— 内容由好学术AI分析文章内容生成,仅供参考。
mRNA疫苗进入人体后极易被降解,因此必须借助脂质纳米颗粒(LNP)作为“运输工具”。但传统LNP 存在一些问题:一方面,它们在体内的真实去向并不清楚;另一方面,大量载体会被肝脏“误捕获”,既降低了靶组织递送效率,也增加了潜在安全风险。
近日,中国科学院精密测量科学与技术创新研究院团队,设计出一种“自带定位信号”的LNP,可高效递送mRNA ,同时可在体内被“实时看见”,为揭示mRNA递送、蛋白表达与免疫激活之间的动态关系提供了新的研究手段。
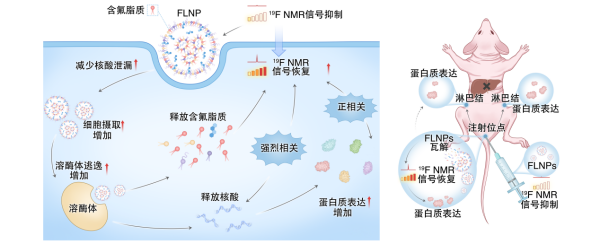
团队在LNP中引入了含氟结构单元,构建了含氟脂质纳米颗粒(FLNP)。这种设计相当于在纳米载体中安装了一个“专属信号灯”,可被19F磁共振成像准确识别,而人体内几乎不存在天然背景信号,因此追踪过程清晰可靠。实验结果显示,这种FLNP在保证mRNA蛋白表达效率与临床常用LNP相当的同时,肝脏非特异性富集明显降低,减少幅度达94.6%。研究人员可在活体条件下,连续观察纳米载体的体内分布、mRNA 释放过程以及抗原表达的时空变化,这是以往方法难以实现的。
在此基础上,团队进一步将“看见的纳米载体”与免疫学分析相结合,在体内建立了一条清晰链条:纳米载体到达哪里 → 抗原在哪里表达 → 免疫细胞如何迁移与激活。研究发现,注射部位首先发生局部免疫激活,随后抗原呈递细胞迁移至引流淋巴结,完成免疫应答的关键启动步骤。
该研究从动态和机制层面回答了mRNA 疫苗“如何在体内发挥作用”的核心问题,为理解免疫激活过程提供了直接证据。同时,该研究建立的FLNP平台兼具准确递送与无创可视化追踪双重优势,为新一代mRNA疫苗和核酸药物的设计、安全性评估及疗效监测提供了重要技术基础。
相关研究成果发表在《美国科学院院刊》(PNAS)上。研究工作得到国家自然科学基金委员会等的支持。
mRNA疫苗递送研究取得进展
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。




















把成像和免疫学连起来很有价值,能直接观察抗原呈递全过程,设计疫苗和评估疗效都方便多了。
这个含氟结构会不会带来长期代谢问题,作者有做毒性或代谢路线的长期随访吗?
前几天看到类似课题,确实一直被追踪难题卡着,团队这步像是把盲点照亮了。
肝脏误捕获降了94.6%?这个数字听着太关键了,后续安全数据想看详细。
这方法挺聪明的,把LNP变成能“自报家门”的感觉很直观。