科学家提出蛋白质—配体复合物柔性结构预测方法PackDock
文章导读
你是否知道,药物设计的关键突破可能正藏在蛋白质的“动态舞蹈”中?传统方法常忽略蛋白质与配体结合时的柔性变化,导致预测失准。现在,中科院上海药物所团队重磅推出全新预测方法PackDock,首次将生成式AI与物理算法深度融合,精准捕捉蛋白—配体结合过程中的构象变化。它不仅能高效建模复杂结合态,还在实际筛选中成功发现纳摩尔级活性抑制剂,展现出强大的药物发现潜力。这项发表于《美国国家科学院院刊》的研究,或将重塑基于结构的药物设计格局。
— 内容由好学术AI分析文章内容生成,仅供参考。
作为细胞的“主力军”,蛋白质往往通过与小分子配体或其他蛋白质发生特异性结合来发挥功能。然而,蛋白质结构具有天然的动态性,配体结合也常伴随构象变化。因此,获得准确的结合构象是基于结构药物设计的重要前提。
近日,中国科学院上海药物研究所研究团队提出了蛋白—配体复合物柔性结构建模新方法PackDock。该方法将生成式AI与物理算法相结合,用于预测柔性蛋白—配体复合物构象。研究显示,该方法在多种应用场景中展现出良好的精度与效率,并兼具较强的泛化能力。
PackDock通过整合物理建模与深度学习方法,来表征蛋白质—配体相互作用,并通过考虑蛋白质在无配体(自由态)与配体结合态下的构象分布,可更精准地建模柔性蛋白—配体复合物的结合构象。同时,其核心模块PackPocket结合等变图神经网络与生成式建模策略,学习侧链构象空间的能量景观,并在不同状态分布中采样口袋侧链构象,以描述结合过程中可能发生的构象变化。研究表明,PackDock框架可兼容多种刚性对接算法,从而进一步提升柔性对接性能。
研究团队通过多项系统性基准测试验证了PackDock的柔性对接性能,即在多种应用场景中,其整体表现优于现有分子对接算法,这表明PackDock能够适配多来源的蛋白结构输入,并以较高精度预测蛋白—配体复合物构象。同时,在针对ALDH1B1的前瞻性虚拟筛选中,PackDock成功识别出具有新型骨架且达到纳摩尔级亲和力的抑制剂,证明了其在实际药物发现流程中的应用潜力。
该方法弥补了静态结构在描绘结合过程与受体柔性方面的不足,有助于学界对生物系统中蛋白—配体相互作用机制的理解。
相关研究成果发表在《美国国家科学院院刊》上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院等的支持。
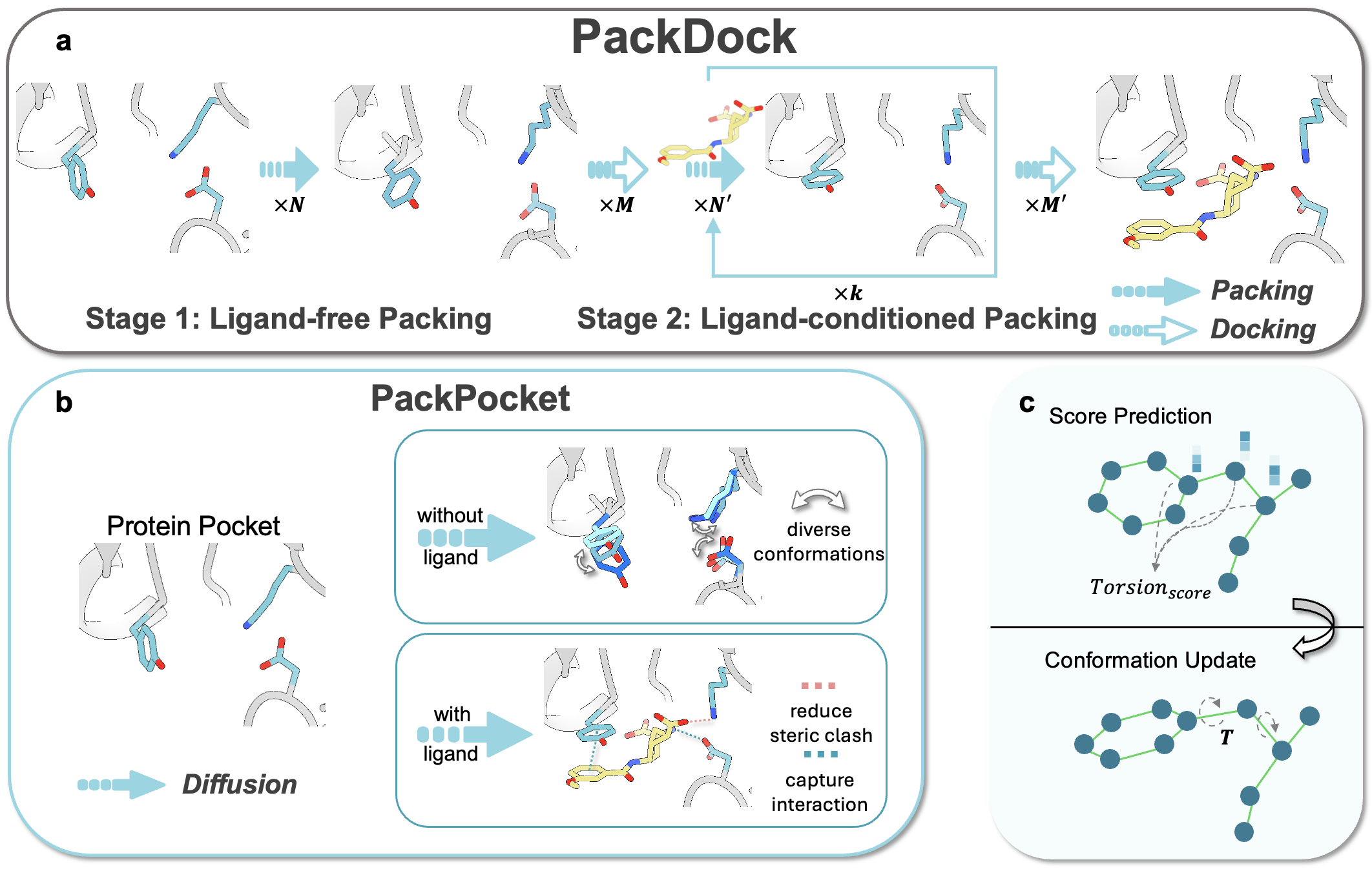
PackDock方法示意图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















这研究把生成式模型和物理建模结合得还行,期待别人复现看看效果到底多稳。
前几天在做对接也遇到侧链移位的问题,真的挺难搞,这方法或许能省不少事。
感觉这解决了静态结构的短板,但实际通用性要看更多不同靶点的测试结果。
实验里能找到纳摩尔级抑制剂很惊艳,说明不仅是理论派,落地也有戏。
如果能把PackPocket开源就好了,想拿来做一下侧链能量景观的对比测试。
这方法看起来挺有意思,尤其是能兼容刚性对接算法,现实应用可能更靠谱些。