研究揭示激酶与磷酸酶“双向制衡”调控植物耐盐性的分子机理
文章导读
植物如何感知盐碱胁迫,并启动精密的“求生”程序?科学家最新发现,植物细胞内部存在一个名为FER-PP2A的“分子天平”。当盐胁迫来袭,一种名为FER的激酶与另一种名为PP2A的磷酸酶,会展开一场相互抑制、动态制衡的“双向拉锯战”,通过精准调控关键蛋白的磷酸化水平,最终影响生长素分布,决定植物的耐盐能力。这项研究不仅揭开了植物耐盐性的新机制,更为未来培育适应盐碱地的高产作物提供了关键的理论靶点。
— 内容由好学术AI分析文章内容生成,仅供参考。
解析植物耐受盐胁迫的分子机理,进而通过科学手段提升作物的耐盐性,对于挖掘盐碱地生产潜力、实现粮食稳产增产具有重要意义。近日,中国科学院分子植物科学卓越创新中心揭示了类受体激酶FERONIA(FER)与磷酸酶PP2A通过“双向制衡”机制,动态调控下游底物蛋白的磷酸化水平,进而增强植物对盐胁迫的适应性。这为理解植物盐胁迫应答提供了新的分子视角,也为作物耐盐性遗传改良提供了新的理论框架。
研究显示,细胞壁糖蛋白LRX3/4/5缺失,导致FER磷酸化水平及其激酶活性下降。研究进一步通过免疫共沉淀结合质谱技术发现,FER与磷酸酶PP2A复合体多个亚基存在相互作用。PP2A复合体能够去除体外FER激酶结构域的磷酸化修饰并抑制其激酶活性,而PP2A磷酸酶抑制剂斑螯素处理或者PP2A亚基突变,能够提升体内FER的磷酸化水平。这表明,PP2A磷酸酶介导FER的去磷酸化,抑制其激酶活性;斑螯素处理可回补lrx345突变体中降低的FER磷酸化水平及激酶活性,并恢复其耐盐性,表明该突变体对盐胁迫敏感的表型主要由FER激酶活性下降所致。
研究发现fer-4突变体背景下PP2A磷酸酶的活性提升,表明FER负调控PP2A的磷酸酶活性。体外激酶实验发现,FER能够直接磷酸化PP2ABα亚基S460位点,且将该位点突变成非磷酸化状态后,可以提高PP2A磷酸酶的活性。这表明,FER和PP2A形成了“相互抑制、动态制衡”的反馈回路。这一双向调控机制如同精密的“分子天平”,通过调节FER与PP2A的活性平衡,控制下游底物的磷酸化状态。
FER-PP2A模块通过调控PIN3蛋白的磷酸化状态,影响生长素分布,从而调控植物耐盐性。FER和PP2A直接结合PIN3,FER-PP2A模块的动态调控决定了PIN3的活性,最终影响植物对盐胁迫的适应能力。
上述研究为理解植物响应盐胁迫的分子调控网络提供了新见解。
相关研究成果在线发表在《当代生物学》(Current Biology)上。研究工作得到国家自然科学基金、国家重点研发计划、中国科学院相关项目等的支持。
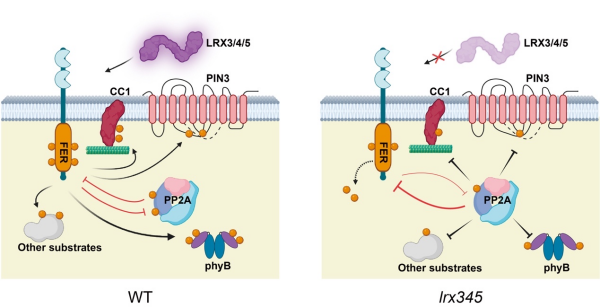
FER-PP2A模块调控底物动态磷酸化和植物耐盐性的工作模型
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















FER直接磷酸化PP2ABα的S460位点这个细节太关键了,稳了
前几天做拟南芥盐胁迫实验刚好遇到类似现象,原来跟PP2A有关
LRX3/4/5缺失影响FER活性?那过表达会不会更耐盐?
这机制有点意思,像跷跷板一样互相压着👍