中山大学殷晓煜团队研究胰腺癌化疗耐药新进展
文章导读
胰腺癌化疗为何频频失效?癌细胞竟有“耐药死循环”!中山大学殷晓煜团队最新研究发现,关键蛋白HNRNPC如同癌细胞“帮凶”——它通过表观遗传开关激活自噬通路,触发肿瘤对吉西他滨的抵抗。更惊人的是,该机制竟形成代谢环路,让耐药性自我强化。但破局利器已现:新型抑制剂673A精准切断该通路,在动物实验中与化疗药物产生协同杀瘤效应!这项发表于《先进科学》的研究,不仅揭开了胰腺癌化疗耐药的核心机制,更为临床克服耐药困境提供了精准靶点,为“癌王”患者照亮治疗新方向。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员康峻鸣)近日,附属第一医院胆胰外科殷晓煜教授团队通过构建患者来源异种移植模型,并结合多组学分析,发现异质核核糖核蛋白C(HNRNPC)在化疗耐药肿瘤中显著上调。体内体外实验进一步证实,HNRNPC的异常高表达可促进PDAC对吉西他滨的耐药性。相关研究成果发表在《先进科学》。
胰腺导管腺癌是一种恶性程度极高的消化系统肿瘤,其中吉西他滨化疗耐药是导致患者预后不良的关键因素。机制研究表明,组蛋白乳酸化修饰驱动了HNRNPC的高表达。HNRNPC以N6-甲基腺苷(m6A)表观遗传依赖的方式上调TNF受体相关因子6(TRAF6)的表达,进而激活自噬通路,介导吉西他滨耐药。
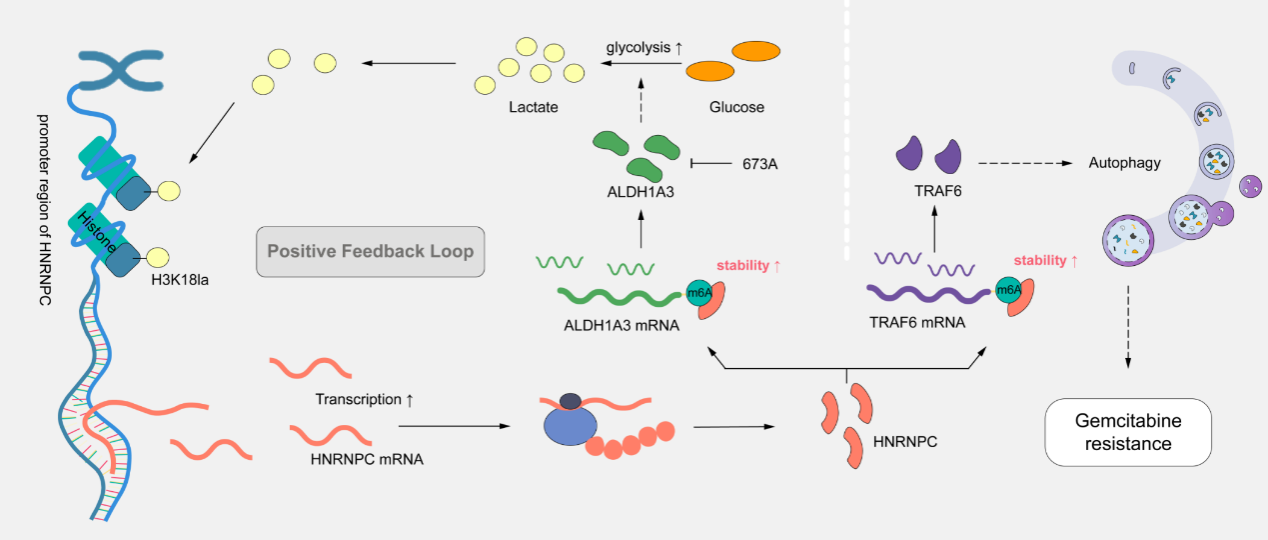
同时,HNRNPC通过调控醛脱氢酶1家族成员A3(ALDH1A3),激活代谢重编程,增强糖酵解并进一步上调组蛋白乳酸化水平,从而形成一条维持化疗耐药的正反馈环路。值得注意的是,ALDH1A3抑制剂673A靶向该调控环路,在PDX模型中与吉西他滨表现出协同抗肿瘤效应。该研究不仅揭示了一个由组蛋白乳酸化驱动、经HNRNPC介导的自噬激活促进胰腺导管腺癌化疗耐药的正反馈机制,也为通过靶向表观遗传介导的代谢重编程来克服PDAC吉西他滨耐药提供了潜在的临床干预策略。
附属第一医院副院长、胆胰外科学科带头人殷晓煜教授为该论文的通讯作者。殷晓煜教授长期致力于胆胰恶性肿瘤的发病机制及精准治疗研究。团队成员,黄锡泰副主任医师、硕士生陈教、博士生朱恩良以及博士后马铭键为该论文的共同第一作者。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















这个正反馈环路的发现很关键
科研人员辛苦了,期待更多突破
有点看不懂专业术语,但感觉很厉害🤔
希望这个发现能尽快应用到临床
这个研究对胰腺癌治疗很有意义👍