研究揭示核纤层蛋白塑造三维基因组空间秩序机制
文章导读
核纤层蛋白不只是细胞骨架——它们竟是基因组的“总建筑师”!中科院最新研究发现,当这些关键蛋白缺失时,70%的基因组定位发生混乱,染色体空间结构崩塌,甚至直接导致细胞增殖能力骤降。研究首次揭示核纤层蛋白通过与核斑蛋白SON相互作用,精确调控着跨度达10Mb的基因组三维构象。更惊人的是,这项发现将核纤层病的认知从“细胞核脆弱”推向“三维基因组紊乱”新范式,为早衰症等疾病提供了全新治疗靶点。想要了解基因组如何在细胞核内精密组织的秘密?这篇研究将颠覆你的认知。
— 内容由好学术AI分析文章内容生成,仅供参考。
核纤层是紧贴内核膜内侧的蛋白网状结构,主要由核纤层蛋白(lamins)及其结合蛋白构成。人类的lamins在发育、衰老及疾病过程中扮演关键角色,分为由LMNA基因编码的A型和分别由LMNB1和LMNB2编码的B型。目前,在LMNA基因中已鉴定出超600种致病突变,这些突变可导致儿童早衰症、扩张型心肌病等多种核纤层病。与核纤层相互作用的大尺度基因组区域被称为核纤层相关结构域(LADs),LADs的核周定位依赖于其与核纤层的相互作用。然而,不同lamins成员在此过程中的具体功能分工,以及它们如何协同维持正常与病理状态下的染色质高级结构,仍有待系统阐明。
近日,中国科学院动物研究所研究团队联合北京基因组研究所(国家生物信息中心)研究团队,揭示了“基因组积木模型”的幕后搭建者——lamins在人类干细胞三维基因组结构中的关键角色,系统绘制了lamins家族缺失下的人类三维表观基因组全景图谱,证明了lamins是基因组—核纤层锚定及大尺度基因组结构的关键调控者,其通过与核斑结构蛋白SON相互作用,精确调控核斑的空间定位与聚集。该研究将核纤层病的病理机制认知从传统的“细胞核机械性脆弱”模型,推动至“三维基因组组织紊乱导致基因表达失调”的新范式,为学界深入理解核纤层病的发病机制提供了新视角。
研究团队在人正常二倍体细胞中实现了lamins家族的系统性敲除。在人胚胎干细胞(hESCs)中,lamins缺失未显著影响干细胞稳态,但在人间充质干细胞(hMSCs)中,B型lamins缺失导致核膜起泡,lamin A/C/B1/B2全敲除(TKO)则引起核形变,使约70%的LAD脱离核周、染色体的定位偏好改变,并伴随细胞增殖能力下降。团队进一步整合了14个维度的表观基因组数据,并结合基因组荧光原位杂交技术,突破了以往研究大多依赖单一技术层面的局限,刷新了领域内对基因组—核纤层锚定模型的认知。
同时,团队根据基因组对lamins的依赖程度,建立了一套新的基因组—核纤层锚定模型,即富集A/T序列且缺乏经典组蛋白修饰的L1区域,依赖lamins的共同锚定,并在TKO后脱离核周;富集H3K9me3修饰的L2区域,由lamins与lamin B受体(LBR)共同锚定,仅在TKO中进一步敲除LBR的条件下脱离核周;富集H3K27me3修饰且位于LAD边界的L3区域,对lamins缺失较为敏感,在单/双敲除条件下即发生脱离。分析发现,不同亚型的inter-LAD(iLAD)——iL1、iL2和iL3,在lamins缺失后遵循不同的转变规律,即富集启动子状态和转录活跃的核斑iL1区域,仅在TKO后从核内翻转至核周;富集增强子状态的iL2区域,在TKO后仍位于核内;富集锌指蛋白基因且位于iLAD边界的iL3区域,在单/双敲除条件下即发生核内向核周翻转。这表明lamins负责将LAD锚定于核周,并对维持特定基因组区域在核内的定位发挥关键作用。
研究进一步提出,lamins是大尺度三维基因组结构的关键组织者,包括染色体疆域、染色质区室互作簇以及跨度达10 Mb以上的mega-loops结构。同时,局部染色质结构及其组织因子CTCF/cohesin的结合模式在lamins缺失时基本得以保留。这提示或存在两种不同的组织原则,分别调控大尺度构象(lamins)与局部构象(CTCF/cohesin)。研究表明,lamins作为关键的结构支架,通过限制LAD之间的接触,以维持染色体疆域的隔离,并通过维持染色体内的长程互作簇来促进染色质压缩。
研究证实,lamin A与核斑支架蛋白SON之间存在相互作用。Lamins缺失导致核斑和iL1富集的核斑结构域(SPADs)从核内翻转至核周,其空间聚集也被破坏,这一系列结构变化引发了全局性转录水平下调。超过75%的下调基因定位于SPADs,并富集于细胞周期通路。其中,生长调控转录因子EGR1的抑制最为显著,这直接损害了细胞的增殖能力。上述发现将干细胞功能障碍置于核纤层病发病机制的核心位置,提示成体干细胞耗竭或是驱动组织退化和早衰的关键因素。重新表达野生型lamin A可部分恢复基因组层级结构、核斑分布与转录水平,而与核纤层病相关的E161K突变体则基本丧失了恢复能力。
该研究在hESCs及其分化来源的hMSCs中构建了lamins的单、双、三敲除模型,系统揭示了lamins在基因组径向定位与空间折叠中的核心作用,为理解生理性衰老及防治衰老相关疾病提供了新线索和潜在靶标。同时,该研究揭示了核纤层病的潜在机制,将相关疾病的病理认知推向了统一的“三维基因组紊乱”框架,为开发靶向lamin-SON轴的治疗策略奠定了理论基础。
相关研究成果发表在《细胞报告》(Cell Reports)上。
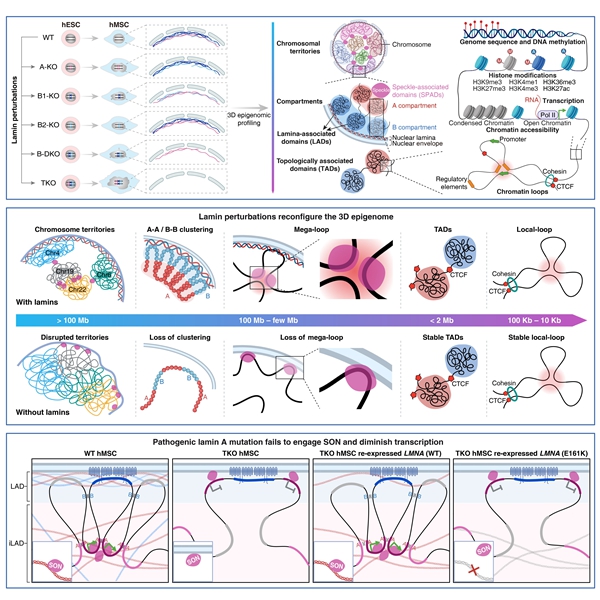
核纤层蛋白家族协同锚定染色质和核斑维持人类三维基因组结构
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...