东南大学李全团队在《德国应用化学》上发表肿瘤精准治疗最新进展
文章导读
癌细胞为何难以根除?关键在线粒体!东南大学李全团队在顶级期刊《德国应用化学》发表的最新综述,首次系统揭示了靶向线粒体的分子工具如何突破肿瘤治疗瓶颈。通过设计特异性药物递送系统,让抗癌药物精准定位到癌细胞"能量工厂",诱导线粒体膜电位崩塌、激活凋亡通路,实现从源头摧毁肿瘤。这不仅为克服传统化疗耐药性提供了全新思路,更开创了智能精准抗癌新模式。想了解这项颠覆性技术如何改写癌症治疗规则?立即阅读全文,掌握未来肿瘤治疗的最前沿突破。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员 汤玉琪)近日,东南大学智能材料研究院院长、首席科学家、化学化工学院李全团队围绕肿瘤精准治疗的靶向线粒体分子工具的设计及应用发表长篇综述论文。相关文章以“ Mitochondria-Targeted Molecular Tools in Precise Tumor Therapy(靶向线粒体的分子工具在精准肿瘤治疗中的应用)”为题发表在国际著名学术期刊《Angewandte Chemie International Edition》(德国应用化学)上,文章的通讯作者为东南大学李全和汤玉琪。
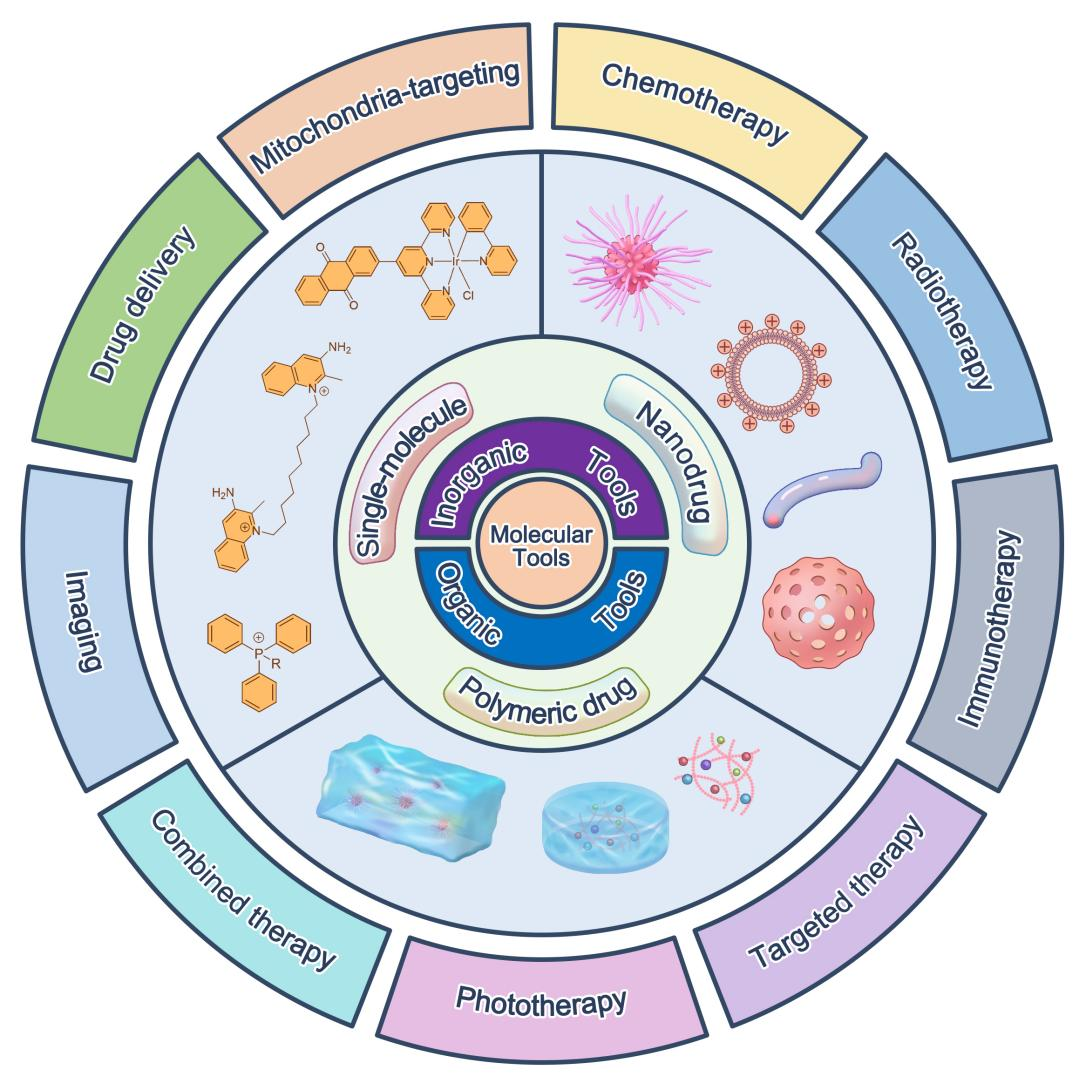
图1. 靶向线粒体的分子工具的分类示意图。(图片来自Angew. Chem. Int. Ed.)。
线粒体作为细胞能量代谢、氧化还原稳态与凋亡信号调控的关键细胞器,在肿瘤的生存和代谢重编程中发挥核心作用,已成为肿瘤精准治疗的关键靶点。目前,线粒体介导的肿瘤靶向治疗仍缺乏高效且非侵入性的调控手段,因此药物递送系统依然是实现线粒体靶向治疗的主要途径和核心策略。基于此,在本综述中李全团队从分子设计策略、递送平台、功能机制以及治疗效果四个维度对这一领域进行全面的综述,包括:一、单分子药物、纳米药物、高分子药物等如何通过结构修饰实现对线粒体的特异性结合;二、各种递送系统(如脂质体、纳米线、自组装多肽等)如何帮助药物突破细胞和线粒体膜障碍;三、这些分子工具通过诱导线粒体膜电位崩塌、活性氧爆发、调控钙离子稳态或诱导线粒体自噬/凋亡通路等发挥抗肿瘤作用的机制;四、结合动物模型与早期临床研究,展示了这些策略在肿瘤治疗中的潜力与挑战,如选择性、生物毒性、耐药机制、可生物降解性等。作者建议未来研究应聚焦于高特异性靶向基团的优化、可降解与智能响应载体的开发,以及与免疫治疗、放疗等其他疗法的联合应用。同时,还需系统评估线粒体功能扰动可能带来的代谢副作用与长期安全风险。总体而言,团队认为线粒体靶向分子工具的发展为精准肿瘤治疗提供了全新的研究思路与技术路径。通过深入理解线粒体生物学与药物递送机制,未来有望实现高效、安全、智能化的抗癌治疗模式,为临床癌症治疗带来新的突破。
该研究工作得到了江苏省”双创团队”计划等项目的资助。
论文链接:https://doi.org/10.1002/anie.202511230
供稿:化学化工学院
(责任编辑:刘明源 审核:宋业春)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...