科研人员构建超声响应型脂质纳米颗粒平台

文章导读
mRNA肿瘤疫苗的免疫原性为何总被化学修饰削弱?中国科学院上海药物研究所团队重磅突破:首创超声响应型脂质纳米颗粒平台!它通过声佐剂脂质在超声刺激下精准激活淋巴结先天免疫反应,不仅将抗原特异性CD8+T细胞反应提升2.5倍,更实现时空可控的免疫调控——联合超声后,小鼠黑色素瘤显著抑制,肝癌移植瘤被安全清除。这项颠覆传统TLR激动剂策略的创新,普适高效递送线性/环状mRNA,为肿瘤疫苗临床转化提供全新路径。告别免疫原性瓶颈,看超声如何重写抗肿瘤免疫游戏规则!
— 内容由好学术AI分析文章内容生成,仅供参考。
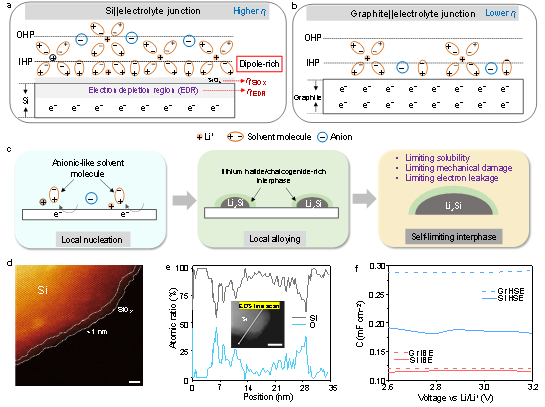
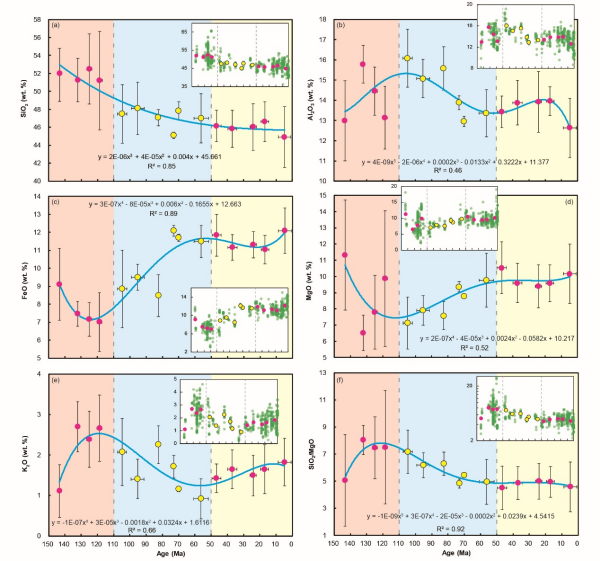
肿瘤疫苗是一种可诱导机体特异性且持久性抗肿瘤免疫应答的治疗手段,有望改善临床肿瘤治疗现状。其中,基于脂质纳米颗粒(LNP)递送的mRNA肿瘤疫苗,作为免疫治疗的前沿技术,已有多款针对肿瘤新抗原的mRNA疫苗进入临床研究。通常,mRNA体外合成时,采用如甲基化假尿苷、5-甲基胞苷等核苷化学修饰策略,以提高其转染能力和体内稳定性。然而,该策略会显著降低mRNA编码肿瘤抗原的免疫原性,阻碍树突细胞(DC)熟化与抗原交叉呈递,限制抗原特异性T细胞免疫反应。
近期,中国科学院上海药物研究所等科研团队,创新性构建了超声响应型脂质纳米颗粒平台。该平台在超声刺激条件下,能时空可控调节淋巴结内先天免疫反应激活。同时,该平台可普适高效递送肿瘤抗原编码线性mRNA或环状mRNA,并在体内诱导强烈且特异的抗肿瘤免疫应答。这项研究展示了刺激响应型免疫佐剂策略,用于增强mRNA肿瘤疫苗的治疗前景。
研究团队开发了一类声敏剂偶联型脂质——声佐剂脂质,其在超声刺激条件下,能精准产生声动力效应,以诱导DC细胞熟化与先天免疫反应激活,即具有超声响应型免疫佐剂活性。随后,研究人员通过微流控装置,快速制备出包载有线性mRNA的超声响应型脂质纳米颗粒(ULNP)。相较于传统TLR激动剂整合的LNP(LNP@CpG),ULNP在联合超声刺激后(ULNP+US),能有效提高淋巴结内先天免疫反应的激活水平,促进DC细胞I型干扰素分泌与抗原交叉呈递,诱导约增加2.5倍的抗原特异性CD8+T细胞反应,并显著抑制小鼠黑色素瘤生长。进一步,该超声响应型免疫佐剂策略可用于增强环状RNA肿瘤疫苗治疗,在包载有肝癌新抗原编码环状RNA的ULNP与超声刺激联合治疗时,能诱导强烈且安全的新抗原特异性抗肿瘤免疫应答,有效消除小鼠原位肝癌移植瘤。因此,声佐剂脂质工程化的超声激活型ULNP,为实现时空可控的先天免疫刺激和mRNA肿瘤疫苗治疗,提供了强有力的临床转化平台。
相关研究成果发表在《美国化学会志》(Journal of the American Chemical Society)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院、上海市等的支持。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...