文章导读
能否跳过繁琐改造,直接用天然内含子实现高效RNA环化?北京大学魏文胜团队带来颠覆性突破!他们开发全新方法CIRC,无需拆分内含子,仅用完整天然序列即可完成环化,效率更高、条件更温和。更令人振奋的是,该技术首次成功环化长达12,206nt的RNA,实现427kDa抗肌萎缩蛋白的完整表达,为杜氏肌营养不良等大蛋白缺陷疾病治疗打开全新通路。这一平台还具备无痕、低免疫原性、易纯化等优势,大幅推进环状RNA疗法的临床转化前景。
— 内容由好学术AI分析文章内容生成,仅供参考。
环状RNA因其高度稳定的结构与高效蛋白编码能力,在RNA疗法领域备受关注。近年来,基于环状RNA的新型治疗策略已在疫苗、体内原位CAR-T、基因编辑及蛋白替代等方面取得进展。其中,北京大学/昌平实验室魏文胜团队此前已报道多项环状RNA平台的重要应用成果,包括:环状RNA新冠疫苗(Cell,2022)1、利用RNA环化策略优化的RNA编辑工具LEAPER 2.0(Nature Biotechnology,2022)2,以及升级版线粒体基因编辑工具mitoBE v2(Nature,2025)3,在蛋白编码与非编码功能实现方面均展示了环状RNA平台的独特优势。
在环状RNA平台中,RNA的体外环化是实现其功能的关键环节。目前常用方法包括化学合成与连接法、酶连接法以及基于核酶(Ribozyme)的环化方法。其中,核酶方法因不依赖蛋白而具有更强的通用性,受到广泛关注。然而,这些方法仍存在局限:例如,应用最广的PIE(Permuted Intron-Exon)方法4需要对自剪接核酶(一型与二型内含子)进行拆分和改造,限制了可用内含子的来源与种类;此外,RNA环化的长度亦受制约;同时,环状RNA的潜在免疫原性以及纯化过程的复杂性,也成为其推广的障碍。这些挑战凸显了开发高效、普适且易用的新型体外环化技术的迫切需求。
2025年8月10日,魏文胜团队在Nature Communications发表题为“Self-splicing RNA circularization facilitated by intact group I and II introns”的研究论文。团队基于一型与二型内含子的第二步剪接反应,开发了两种全新的体外RNA环化方法:PIET(Permuted Intron-Exon through Trans-splicing)与CIRC(Complete self-splicing Intron for RNA Circularization)。PIET是一种两组分RNA环化体系,可通过调节组分比例控制环化效率;而CIRC完全摒弃了内含子拆分与改造的需求,可直接利用多种天然完整内含子完成环化,显著拓宽了可选内含子范围,并为筛选更高效或具特殊功能的天然内含子提供了可能。与PIE相比,CIRC不仅环化效率更高,还能在低Mg²⁺或低pH等温和条件下保持高活性,有利于RNA完整性和质量保持。
在本研究中,CIRC方法突破了现有环状RNA平台的载量上限,首次成功环化12,206nt、编码427kDa全长抗肌萎缩蛋白(dystrophin)的RNA,并在细胞中实现了完整蛋白的表达。这一成果刷新了环状RNA可承载RNA分子的长度纪录,为杜氏肌营养不良症(DMD)等大蛋白缺陷相关疾病的蛋白替代疗法开辟了新路径。此外,CIRC方法还能实现无痕(scarless)环状RNA制备,产物免疫原性低,并可在内含子中引入poly(A)序列,从而与基于oligo(dT)的纯化体系兼容,大幅简化了生产纯化流程。
这一研究构想源于团队在2023年初使用PIE方法制备环状RNA时提出的“是否可跳过第一步剪接反应,直接利用第二步反应实现环化”假设,实验验证了这一设想,并据此开发出依赖双组分RNA反式剪接活性的环化方法PIET(图1)。
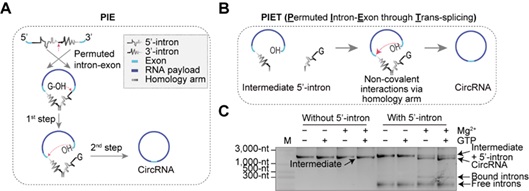
图1 PIET方法的开发示意图
研究团队进一步推测,将PIET方法中的非共价连接改为共价连接,内含子依然可能保持活性。实验结果证实了这一推测,并发现去除PIE与PIET方法中所需的同源臂后,环化效率显著提高。由于该策略允许使用天然完整内含子实现RNA环化,研究者将其命名为CIRC(图2)。
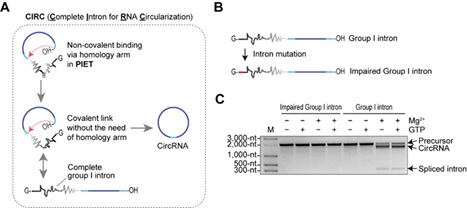
图2 从PIET到CIRC
CIRC方法不仅能高效兼容原PIE方法中的内含子,还可适配10余种来自自然界的一型和二型内含子,证明了其广泛适用性。这为未来从自然界筛选更高效或具特定功能的内含子提供了更多可能。此外,与PIE方法相比,CIRC方法在温和条件下表现出更高的环化效率与反应速率,对保持长RNA的完整性尤为有利。利用这一优势,团队系统评估了CIRC方法在大分子RNA环化中的能力,成功制备载荷长度从1448nt到12,206nt的环状RNA,并首次验证最大载荷RNA在细胞内的蛋白表达(图3),实现了全长抗肌萎缩蛋白的环化与表达,为相关疾病的大分子蛋白替代疗法奠定了技术基础。
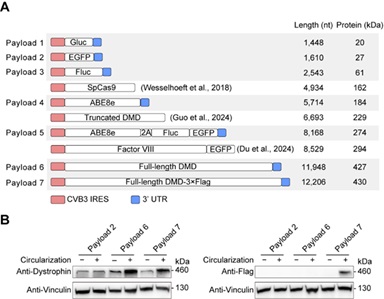
图3 CIRC方法突破了目前环状RNA平台的载量限制
本研究不仅为RNA体外环化提供了全新的技术路线,也极大拓展了环状RNA平台的应用潜力,对未来RNA疗法的开发与优化具有重要意义。
魏文胜课题组前沿交叉学科研究院2020级毕业生沈勇博士与生命科学学院2024级博士研究生李帛翰为本论文共同第一作者。昌平实验室董蕾,北京大学前沿交叉学科研究院博士研究生唐玮(2021级)、任纪武(2023级)、陈奉(2021级),生命科学学院2019级毕业生郑文娟博士、科研助理于莹博士与圆因生物高璐博士对本研究作出了重要贡献。研究获得了昌平实验室及北大-清华生命科学联合中心的资助。
参考文献:
1. Qu, L. et al. Circular RNA vaccines against SARS-CoV-2 and emerging variants. Cell 185, 1728—1744 e1716 (2022).
2. Yi, Z. et al. Engineered circular ADAR-recruiting RNAs increase the efficiency and fidelity of RNA editing in vitro and in vivo. Nat Biotechnol 40, 946—955 (2022).
3. Zhang, X. et al. Precise modelling of mitochondrial diseases using optimized mitoBEs. Nature 639, 735—745 (2025).
4. Wesselhoeft, R. A., Kowalski, P. S. & Anderson, D. G. Engineering circular RNA for potent and stable translation in eukaryotic cells. Nat Commun 9, 2629 (2018).
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...