文章导读
氧杂环药物合成为何总卡在立体选择性难关?易氧化开环、无法安装导向基团,让传统方法束手无策。武汉大学孔望清团队却用氢原子转移(HAT)与金属协同催化,一举破解非导向氧杂环α-C(sp3)-H官能化难题!本文深度解析他们实现的不对称芳基化、烯基化及全球首创的烷基化突破,揭秘如何精准构建手性骨架,更以糖苷合成等案例验证药物应用价值。15秒掌握前沿策略,为你的药物研发开辟高效新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员高妍)近日,武汉大学高等研究院孔望清教授在Accounts of Chemical Research上发表专题综述“Stereoselective Nondirectedα-C(sp3)–H Functionalization of Oxygen Heterocycles”,系统总结了该团队近年来通过氢原子转移(HAT)与金属协同催化实现非导向氧杂环化合物立体选择性官能化方面取得的特色成果,并对该领域的未来发展方向给出了具有前瞻性的展望。高等研究院特聘副研究员平媛媛和博士研究生许盛为第一作者,孔望清为通讯作者,高等研究院为论文的第一署名单位。
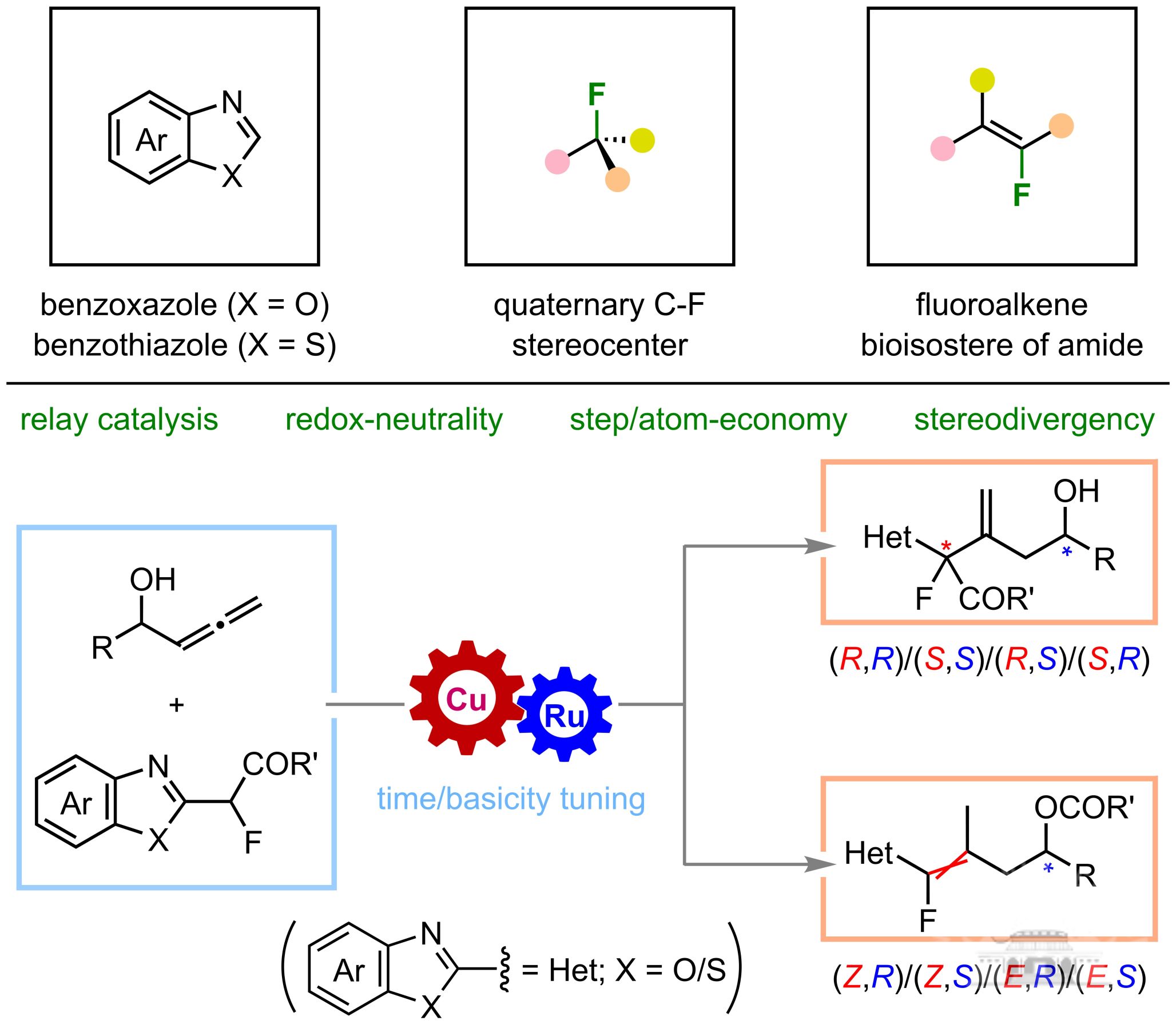
含氧杂环化合物作为一类重要的有机分子骨架,其生物学意义在药物研发领域日益凸显。近年来,这类化合物的不对称合成研究取得了显著进展,然而现有合成策略在骨架多样性、原料可获得性、底物普适性以及立体选择性控制等方面仍存在诸多挑战。相较于繁琐的从头合成策略,以简单易得的饱和杂环化合物作为前体,其C(sp3)−H键的直接官能化被认为是一种极具潜力的策略,为手性杂环药物分子的设计与开发提供了新思路。然而,由于饱和氧杂环化合物易于被氧化开环、而且不能像氮杂环那样安装导向基团来控制立体选择性,其催化对映选择性C(sp3)−H官能化是有机合成领域亟待突破的科学难题。
针对这一挑战性课题,孔望清研究团队系统性地开展了通过氢原子转移(HAT)与金属协同催化来实现非导向含氧杂环立体选择性官能化的研究,并取得系列重要突破。首先,该团队以易得的氧杂环化合物为原料,成功实现了不对称C(sp3)−H芳基化和烯基化反应,高效构建了多种高附加值手性氧杂环骨架。该研究深入探究了环效应、配体类型及光催化剂等因素对C(sp3)−C(sp2)键形成的调控机制,阐明了各催化组分的协同作用原理。随后,该团队创新性地开发了氧化氢原子转移与还原偶联协同催化体系,率先实现了饱和杂环化合物的不对称C(sp3)−H烷基化反应,为立体选择性构建C(sp3)−C(sp3)键提供了全新的解决方案。此外,团队还开发了以1-脱氧糖苷作为糖基给体合成多种类型C-糖苷类化合物的通用合成方法。该团队还发展了通过配体的位阻来精准调控碳水化合物位点选择性官能化,为异头碳糖苷和含芳基季碳立体中心的特殊碳水化合物的发散性合成开辟了新途径。这些创新性方法的合成价值已通过多种天然产物、重要药物分子及关键合成砌块的高效构建得到充分验证,为含氧杂环化合物的精准合成提供了重要的方法论指导。

该研究工作得到了国家自然科学基金、南京大学化学化工学院配位化学国家重点实验室开放研究基金、湖北省自然科学基金及广东省基础与应用基础研究基金的经费支持。
论文链接:https://pubs.acs.org/doi/10.1021/acs.accounts.5c00355
(供图:高等研究院 编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...