文章导读
你是否好奇为何过敏原能引发免疫风暴?清华、中科院团队在《自然》杂志发表突破研究:揭示多种过敏原(如链格孢菌)通过Aeg-S/Aeg-L蛋白协同形成呼吸道上皮细胞膜穿孔,诱导钙离子内流和IL-33释放,激活二型免疫导致过敏。更惊人的是,细菌、真菌等来源的穿孔毒素均能类似触发反应,证明“膜穿孔”是二型免疫的共通危险信号。这一发现填补了长期悬而未决的先天免疫识别空白,颠覆传统认知,为过敏机制解析和治疗策略开辟全新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
7月30日,《自然》(Nature)杂志在线发表了清华大学生物医学交叉研究院徐墨课题组、中国科学院(以下简称“中科院”)生物物理所高璞课题组、清华生物医学交叉研究院邵峰课题组合作完成的题为“上皮细胞膜穿孔诱发过敏性气道炎症”(Epithelial cell membrane perforation induces allergic airway inflammation)的研究论文。该研究发现,在呼吸道上皮细胞膜上形成跨膜孔洞的活性,作为一种普适的二型免疫刺激,存在于多种过敏原中,此活性通过诱导钙离子内流和IL-33释放,激活下游过敏反应。这项研究揭示了过敏原诱导免疫应答的共通分子机制,填补了长期悬而未决的二型先天免疫识别知识缺口,拓展了对过敏发生机制的基础认识。
免疫系统分三型应对入侵:一型清除胞内病原体(依赖NK细胞等),二型防御多细胞寄生虫及介导过敏(依赖ILC2等),三型抵御胞外细菌/真菌(依赖ILC3等)。20世纪90年代“模式识别”假说及后续研究揭示了一型、三型免疫的先天识别机制,但二型免疫的识别机制长期空白——多样的刺激物(如过敏原、寄生虫)如何被共同识别,宿主又通过何种机制感知,均不明确。本研究即针对这一核心问题展开。
为探索二型免疫先天识别机制,徐墨实验室建立体外细胞培养体系,旨在模拟过敏原/寄生虫诱导先天免疫的早期过程。该体系用于:(1)从复杂刺激物中追踪纯化活性成分;(2)通过CRISPR筛选寻找宿主识别受体和信号通路。
团队筛选多种二型免疫刺激物作用于不同屏障细胞系,发现霉菌过敏原链格孢菌(Alternaria alternata)能在肺上皮细胞系和小鼠呼吸道诱导相同的早期反应(IL-33释放、MAPK激活、炎症因子表达),证明体外体系成功重建体内过程。
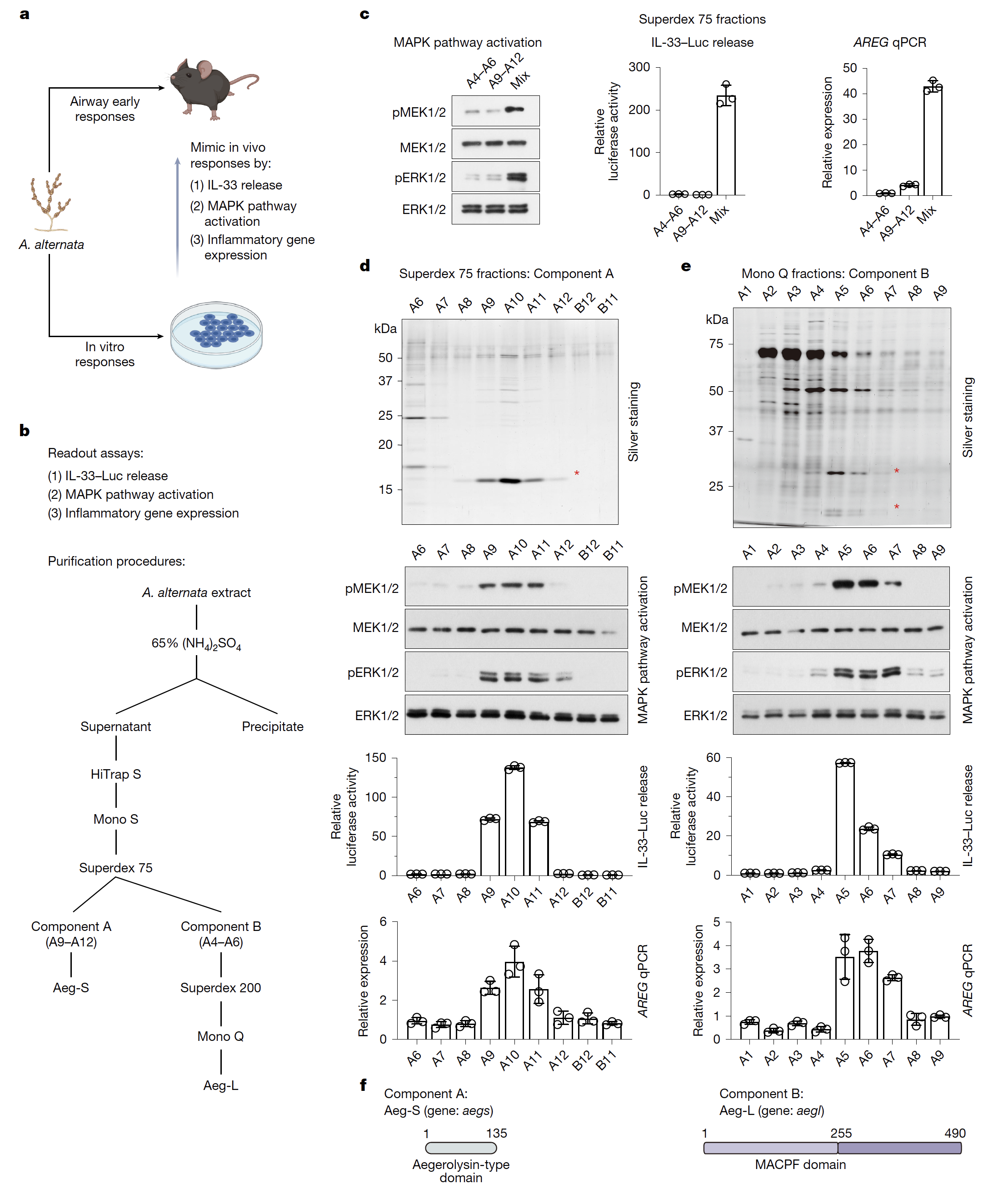
图1.Aeg-S与Aeg-L是链格孢菌(A. alternata)的核心免疫激活成分的鉴定
链格孢菌是一种植物寄生真菌,广泛分布于全球各地,夏秋季节其孢子随空气传播,成为常见的呼吸道敏原。据流行病学研究,在某些地区,该霉菌可能与超过20%的季节性呼吸道过敏病例有关。
以链格孢菌提取物为起点,经活性追踪纯化,研究团队鉴定出核心活性组分为两个蛋白:16.5kDa的Aeg-S(aegerolysin家族)和55kDa的Aeg-L(含MACPF结构域)。它们协同形成二元穿孔毒素。这类系统在主要真菌过敏原属(链格孢菌、曲霉、青霉)中保守存在。
高璞团队通过冷冻电镜解析了Aeg-S/Aeg-L复合物结构。它们结合富含鞘磷脂和胆固醇的膜,协同组装成大型环状跨膜孔道(如18聚体:外径~23.2nm,内径~9.2nm),揭示了膜穿孔的分子机制。
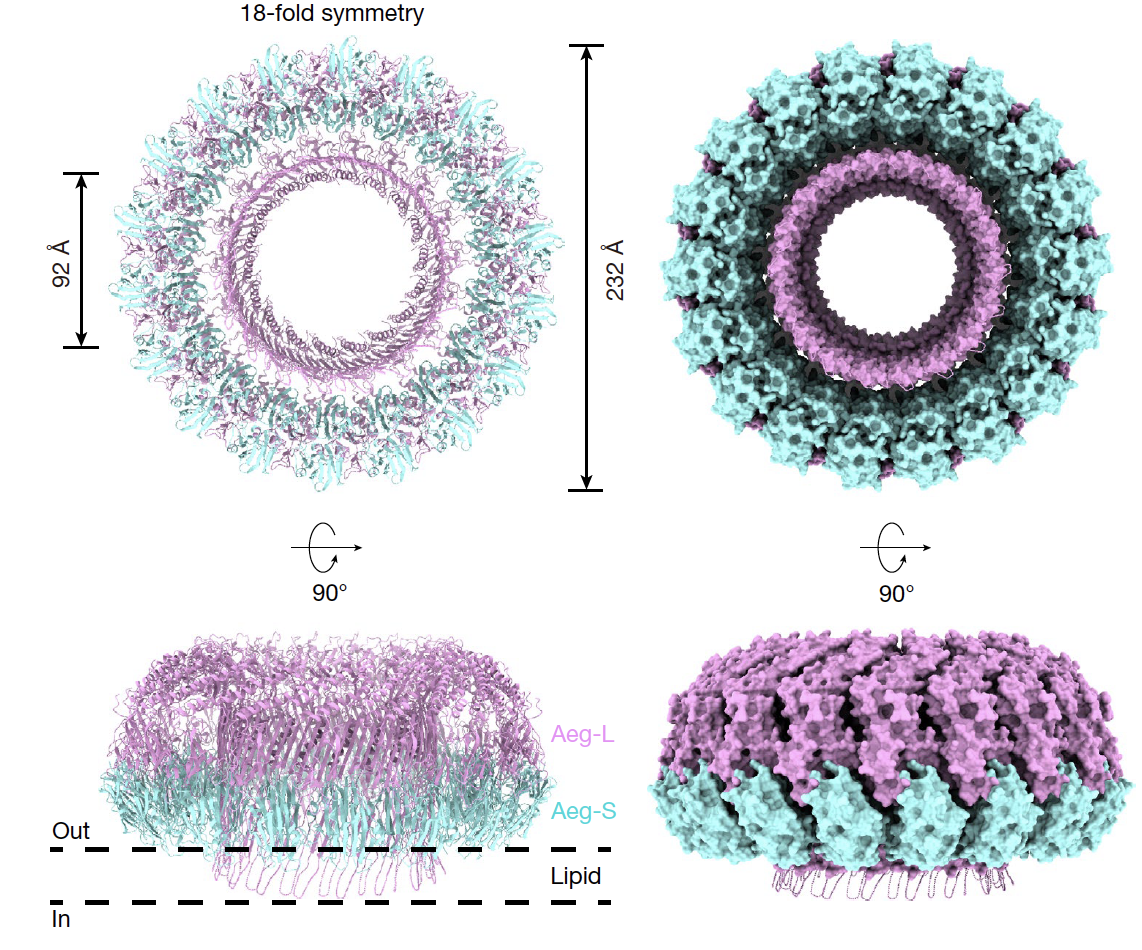
图2.Aeg-S与Aeg-L(Aeg-S/L)孔道复合物的冷冻电镜结构解析
体外研究表明,Aeg-S/Aeg-L介导的膜穿孔通过两条途径激活二型免疫:(1)诱导IL-33释放;(2)引发钙离子内流,进而激活MAPK通路,驱动炎症基因表达。钙内流是MAPK激活的前提。ATP等警报素也被释放。
Aeg-S与Aeg-L重组蛋白联合滴鼻可强烈诱导小鼠呼吸道过敏(早期应答及典型炎症:嗜酸粒浸润、Th2积累、IgE升高),单独使用无效。与LPS对比显示,它们专一诱导Th2/IgE反应,而非Th1/Th17反应。
敲除链格孢菌的`aegs`或`aegl`基因后,其提取物失去致敏能力(无Th2积聚、嗜酸粒浸润、IgE升高)。回补相应重组蛋白可恢复致敏能力,证明Aeg-S/Aeg-L协同成孔是该真菌的核心致敏机制。
研究进一步发现,多种来源、结构和机制各异的穿孔毒素(PFTs,来自黑曲霉、海葵、蚯蚓、蘑菇、细菌等),尽管形成孔径不同(~3-45nm),均能通过滴鼻诱导小鼠呼吸道过敏。这表明呼吸道上皮细胞膜穿孔是二型免疫识别的共通“危险特征”。
综上所述,本研究阐明了链格孢菌通过Aeg-S/Aeg-L协同穿孔激活二型免疫的机制。更重要的是,发现多种PFTs均可通过类似机制诱导过敏,提示“细胞膜穿孔”是引发二型免疫应答的共通信号。这为理解二型免疫先天识别提供了新认知:不同于一型/三型免疫识别特定分子模式,二型免疫可能更倾向于感知组织损伤(如膜穿孔)。该发现提出了组织微环境影响免疫结局的新问题,并为研究二型免疫早期过程提供了新工具。
北京生命科学研究所/清华大学生物医学交叉研究院徐墨研究员、中科院生物物理研究所高璞研究员为本论文的共同通讯作者,邵峰研究员为研究提供了关键支持。徐墨实验室的毕业生史可见博士、博士研究生吕垚,高璞实验室的赵春秋博士为论文的共同第一作者。邵峰实验室的曾欢博士、徐墨实验室技术员王叶琼为研究作出了重要贡献。本论文的其他作者包括刘宇璇、李琳和陈涉博士。北京生命科学研究所/清华大学生物医学交叉研究院的影像中心、蛋白质中心,以及中科院生物物理研究所的生物影像与蛋白质科学公共平台为本研究提供了支持。本研究在北京生命科学研究所和中科院生物物理研究所完成,得到了北京市科委前沿创新培育项目(Z201100005320011,Z211100003321008,Z221100003422014,资助人:徐墨)、国家自然科学基金(32325028和32130057,资助人:高璞)以及北京生命科学研究所/清华大学生物医学交叉研究院的资助。
论文链接:
https://www.nature.com/articles/s41586-025-09331-1
供稿:生物医学交叉研究院
编辑:郑青春
审核:黄思南
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...