中国农业大学动科学院李胜利教授团队在围产期奶牛胃肠道菌群驱动酮病发生的机制研究中取得系列新进展
文章导读
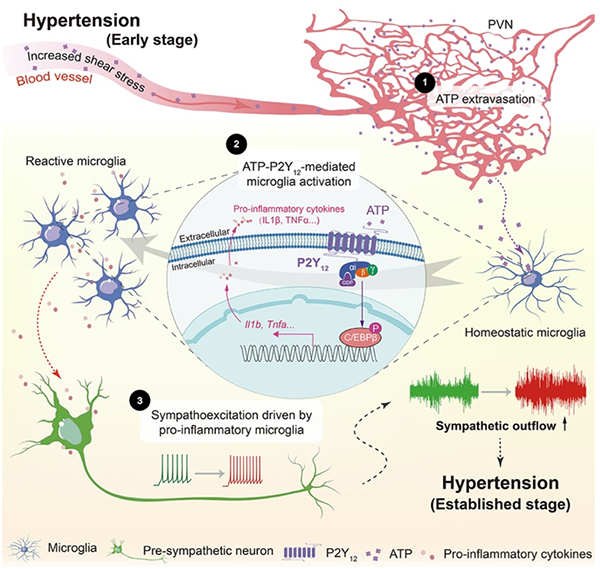
你是否知道,一头奶牛产后生病,竟可能威胁人类健康?中国农大李胜利教授团队最新研究颠覆传统认知,揭开酮病背后的“菌群密码”:瘤胃与后肠微生物竟通过“肠-肝轴”联手驱动代谢紊乱!更惊人的是,病牛肠道竟藏匿大量抗药基因,或通过食物链反噬人类。四篇国际顶刊论文连发,首次绘制菌群演替时空图谱,发现关键菌株Ruminococcus_E bovis缺失致酮病的新通路,并锁定“乙酸—AMPK—PPARA”因果链条。不止于防控酮病,更警示养殖业的潜在人畜共患风险。这不仅是一场动物医学的突破,更关乎你我餐桌安全。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,我校动物科学技术学院李胜利教授团队在国际权威期刊 Research、Microbiome、GigaScience、Journal of Hazardous Materials 连续发表四篇高水平研究论文,系统揭示了围产期奶牛胃肠道微生物组与产后能量代谢紊乱(酮病)之间的深层互作机制,为开发新型干预策略提供了重要理论支撑。
这些研究在理论上突破了传统的“肝脏中心论”认知,揭示瘤胃和后肠菌群共同调节宿主能量代谢的机制;在应用层面,则为围产期奶牛微生态制剂研发和精准营养干预方案的设计奠定了坚实基础,展现出广阔的应用前景。该研究成果不仅体现了本团队在围产期奶牛健康管理领域的深厚积累,同时彰显了我校在动物营养与肠道菌群调控研究方面的创新实力,还为推动奶牛健康管理和高效生产提供了有力支撑。
四篇论文分别是《围产期奶牛瘤胃与粪便微生物组的确定性演替模式与宿主代谢变化相关联》(Deterministic succession patterns in the rumen and fecal microbiome associate with host metabolic shifts in peripartum dairy cattle)、《源自牛瘤胃球菌 _E bovis 的丙氨酸通过提供生糖前体缓解围产期能量代谢紊乱》(Alanine derived from Ruminococcus_E bovis alleviates energy metabolic disorders during the peripartum period by providing glucogenic precursors)、《后肠微生物组稳态破坏通过抑制乙酸介导的肝脏AMPK-PPARA轴促进反刍动物产后能量代谢紊乱》(Disruption of hindgut microbiome homeostasis promotes postpartum energy metabolism disorders in dairy ruminants by inhibiting acetate-mediated hepatic AMPK-PPARA axis)和《奶牛生产系统中亚临床疾病通过肠道微生物网络增加抗生素抗性及毒力因子基因的人畜共患风险》(Subclinical disease elevates zoonotic risks of antibiotic resistance and virulence factor genes through gut microbial network in dairy cow production system)
酮病是奶牛产后健康管理中的一大难题。从统计数据来看,全球有30%到50%的奶牛在产后的关键几周容易患上酮病,每年给全球造成约二十亿美元的经济损失。长期以来,该领域的科学研究以及防控策略主要集中在肝脏的“营养重分配”。然而,这种以“肝脏中心论”为核心的传统研究范式,在深入揭示酮病的深层驱动因素以及实现有效的防控措施方面,逐渐遇到了瓶颈,难以有效遏制酮病的高发态势。
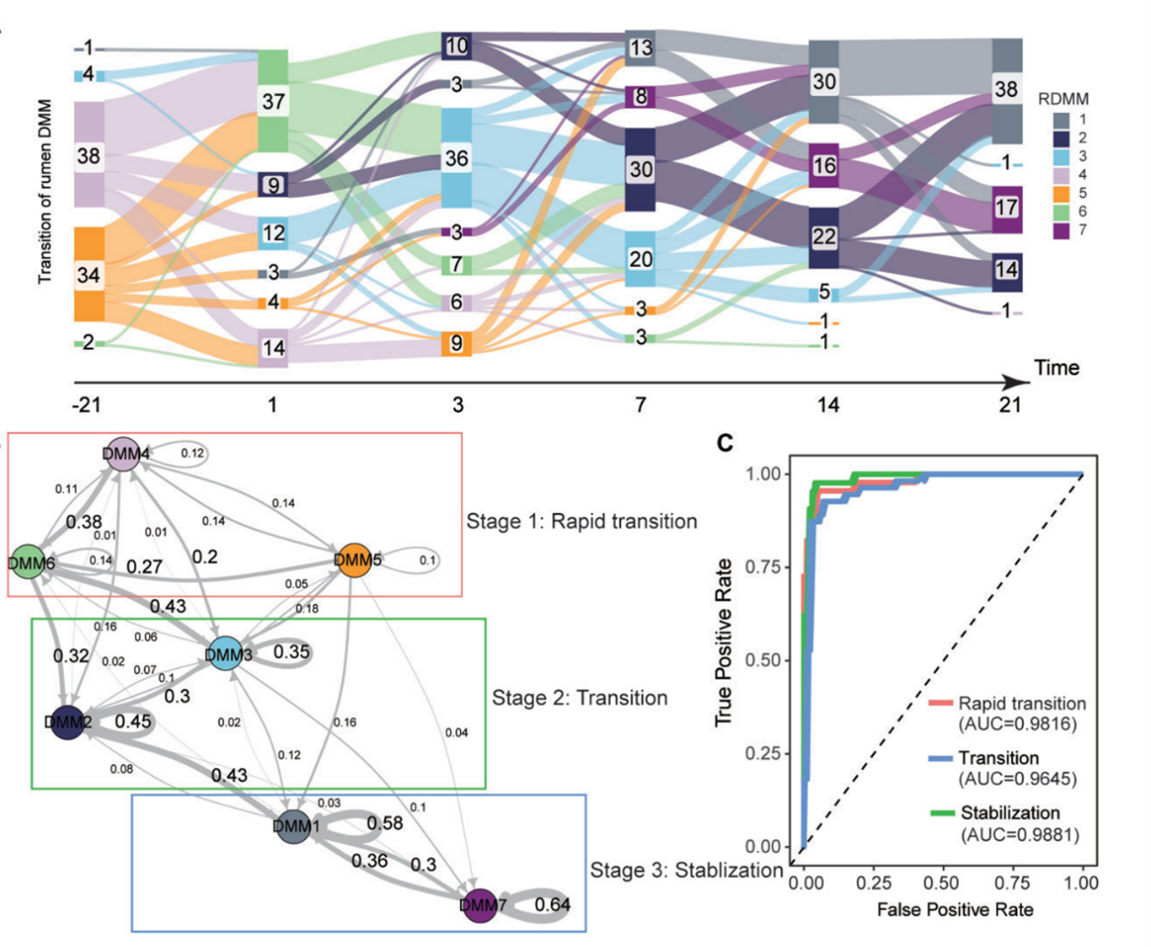
围产期奶牛瘤胃菌群演替模式
研究揭示奶牛围产期瘤胃与后肠菌群的差异化三阶段演替规律及其生态位构建平衡机制。首次绘制围产期奶牛肠道微生物的时空图谱, 揭示:瘤胃菌群呈现”快速过渡-过渡-稳定”的三阶段演替模式,而后肠道菌群则表现为”稳定-过渡-稳定”的独特演替模式。其中,关键功能菌属(如瘤胃中的 Succiniclasticum 和后肠道中的 Bifidobacterium )通过平衡随机性与确定性过程,驱动微生物群落重构。
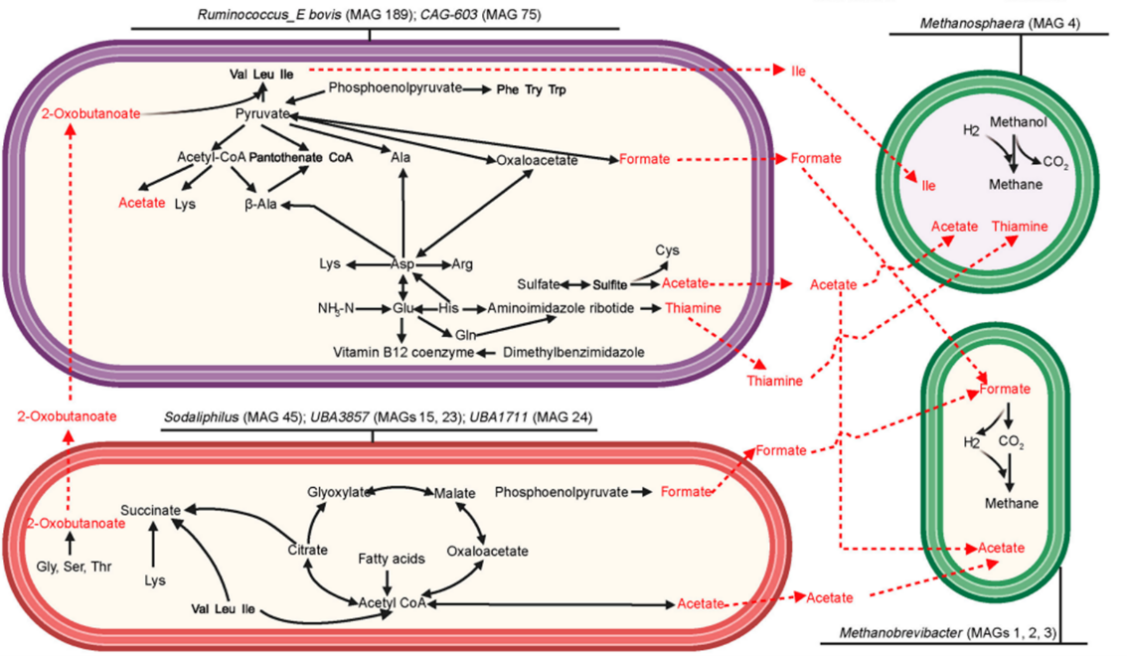
关键MAGs之间存在的代谢互作
界定瘤胃菌源MCP-Ala合成障碍为酮病发生新诱因。酮病奶牛瘤胃微生物中 Ruminococcus_E bovis 缺失导致瘤胃微生物合成MCP(菌体蛋白)的能力降低,导致流入肝脏中AA数量降低和代谢功能减弱。体外单菌添加和原代肝细胞培养试验综合表明瘤胃菌群通过 Ruminococcus_E bovis →MCP及其组成中的Ala→肝脏AA代谢→GLU→BHBA通路预防酮病发生。
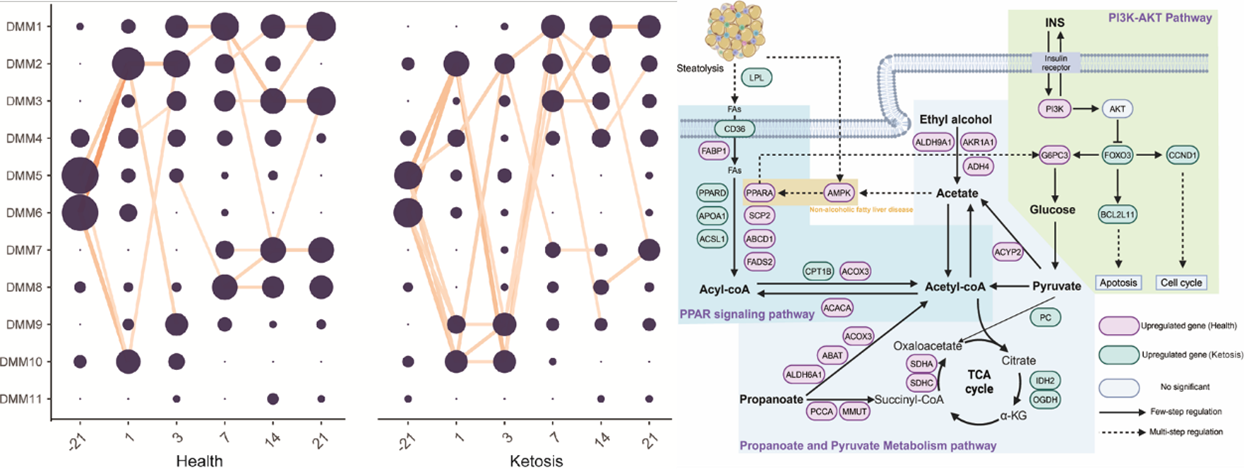
围产期奶牛粪便菌群演替失衡(左);肝脏关键代谢通路(右)
解析后肠菌群演替失衡通过“肠-肝”轴诱发酮病的因果链。酮病奶牛产后粪便菌群演替失衡, Faecousia sp017465625等关键菌株丰度显著降低而 Methanosphaera sp016282985和 Bifidobacterium globosum 等关键菌株丰度显著升高,导致后肠道乙酸和丙酸产生失衡。通过多组学结合体外验证试验构建了”粪便关键微生物失衡→乙酸产生减少→AMPK/PPARA信号通路抑制→肝脏脂质沉积→酮病发生”的完整因果链。
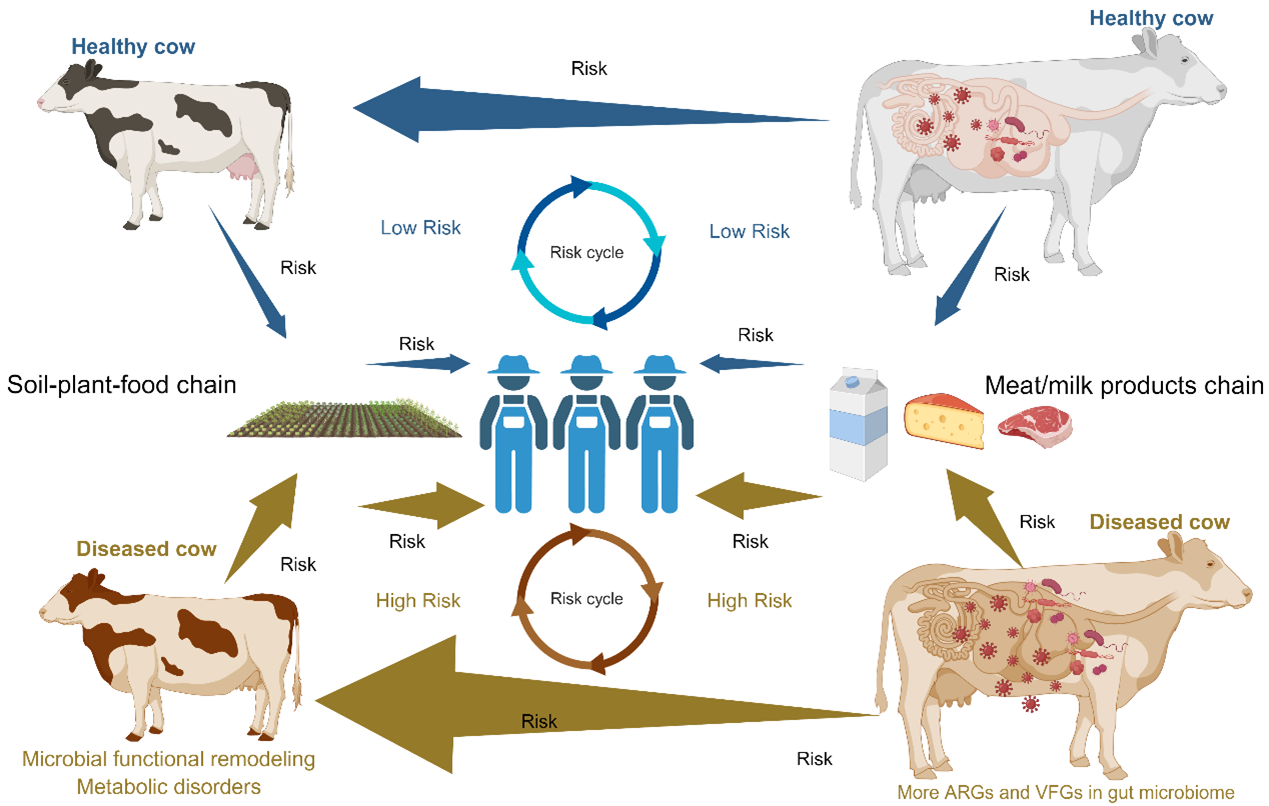
酮病奶牛胃肠道菌群介导的“宿主-人类”健康风险传递链
发现酮病奶牛的胃肠道菌群是威胁宿主与人类健康的“沉默基因库”。首次发现酮病奶牛胃肠道菌群携带的抗生素抗性基因(ARGs)和毒力因子基因(VFGs)数量显著增加。这些基因可通过转座酶(tnpA)等移动遗传元件(MGEs)介导的水平转移进行传播。基于MetaCompare2数据库的风险评估表明,酮病奶牛胃肠道菌群对人类健康风险评分较健康组奶牛更高。此外,特定的ARGs/VFGs(如FosM1)与奶牛宿主代谢紊乱相关,可能通过胆汁酸和神经递质通路参与酮病的病理进程。
中国农业大学为论文的第一完成单位,李胜利教授和王蔚副教授为论文的通讯作者,动科院博士生王硕和孔凡林为论文的共同第一作者。中国农业大学动物科学技术学院曹志军教授、杨红建教授、王雅晶高级畜牧师、郝阳毅博士、中国农业科学院饲料研究所毕研亮研究员和大同市四方高科奶牛场对本研究给予了大力支持,博士生李琛、戴东文、张鑫玥以及南京农业大学动医学院张艺佳讲师和浙江农林大学王二旦讲师参与了该研究。相关工作得到国家自然科学基金重点项目(项目号:32130100)、“十四五”重点研发计划奶业全产业链项目(项目号:2022YFD1301001)及“十四五”重点研发计划青年科学家项目(项目号:2022YFD1301400)的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...