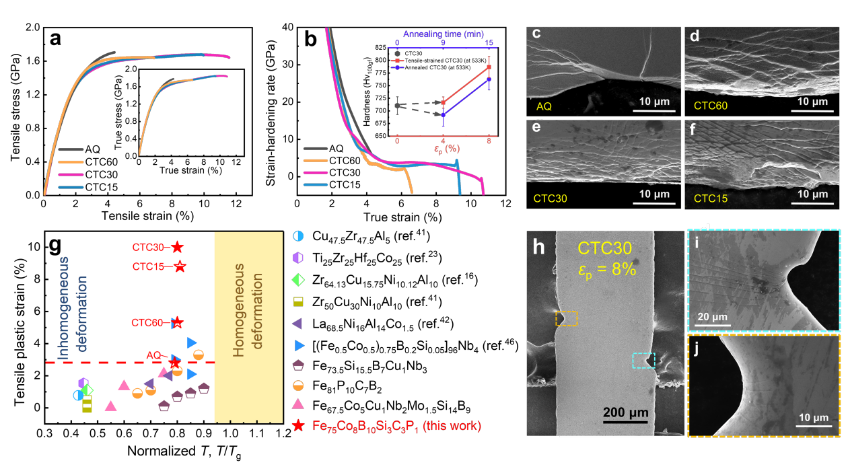
文章导读
西安交通大学药学院张彦民教授团队通过CRISPR/Cas9全基因组筛选技术首次发现锌指蛋白ZNF27是肝癌瑞戈非尼治疗耐药的核心驱动基因。研究结合蛋白组学与乳酸化修饰组学分析,揭示ZNF27通过促使PRDX1 K67位点乳酸化修饰,增强NRF2核易位并激活铁死亡抵抗通路,从而导致耐药的新机制。团队进一步验证敲低ZNF27或抑制其下游信号轴可有效逆转耐药现象。该成果为突破中晚期肝癌二线靶向治疗困境提供了理论基础,相关论文已发表于药学顶级期刊《药物耐药进展》(IF 21.7)。研究团队包括第一作者助理教授杨天枫,研究获得国家自然科学基金、陕西省杰出青年科学基金及中国博士后科学基金联合资助,该项目总资助金额度未明确,西安交通大学为唯一通讯单位。
— 内容由好学术AI分析文章内容生成,仅供参考。
瑞戈非尼是晚期肝癌患者索拉非尼治疗无效后的关键二线治疗药物,为全球每年约30万患者的生存带来了新希望。然而,目前中晚期肝癌患者在瑞戈非尼二线治疗失败后尚无其他可选的靶向药物。因此,迫切需要明确介导瑞戈非尼耐药的潜在因素和靶点。
针对以上问题,药学院张彦民教授团队通过CRISPR/Cas9全基因组敲除文库筛选技术发现锌指蛋白ZNF207是肝癌瑞戈非尼治疗的关键耐药驱动基因。通过整合高通量CRISPR筛选和蛋白组学、乳酸化修饰组学等多组学分析,研究团队进一步阐明了ZNF207通过诱导乳酸堆积抑制铁死亡来促进瑞戈非尼耐药的作用机制。
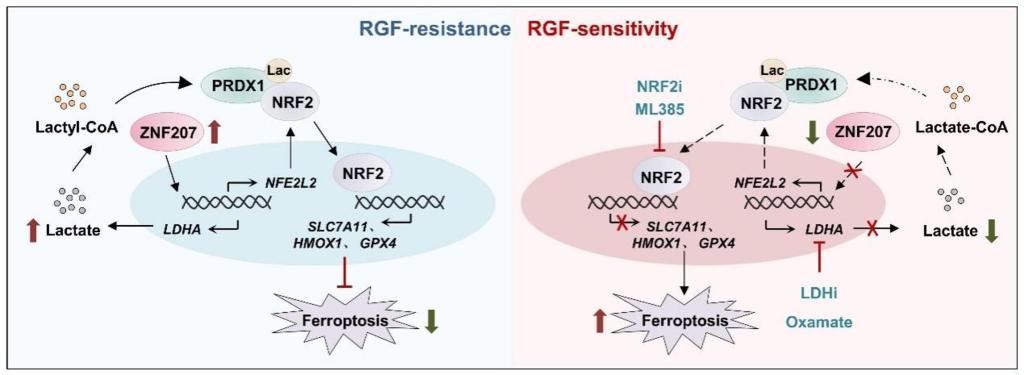
细胞代谢过程中乳酸的累积可导致蛋白质的赖氨酸残基发生乳酸化修饰,参与血管生成、糖酵解、巨噬细胞极化等多种细胞生命活动的调控,组蛋白或非组蛋白的乳酸化修饰与肿瘤化疗及靶向治疗耐药密切相关。研究团队通过4D-FastDIA乳酸化修饰组学技术结合ChIP-qPCR等方法,发现ZNF207通过促进过氧化物还原蛋白PRDX1 K67位点的乳酸化修饰,增强核转录因子NRF2的核易位,进而激活下游铁死亡抵抗信号通路,促进瑞戈非尼耐药细胞产生铁死亡抵抗;并证明了敲低ZNF207、抑制PRDX1的乳酸化修饰或NRF2激活,能够有效逆转肝癌瑞戈非尼的耐药。本研究揭示了ZNF207介导的蛋白质乳酸化修饰在瑞戈非尼耐药中的关键作用,阐明了瑞戈非尼耐药的作用机制,提出了靶向抑制ZNF207/PRDX1lac/NRF2信号轴的激活可作为一种有效克服肿瘤治疗耐药的干预策略。
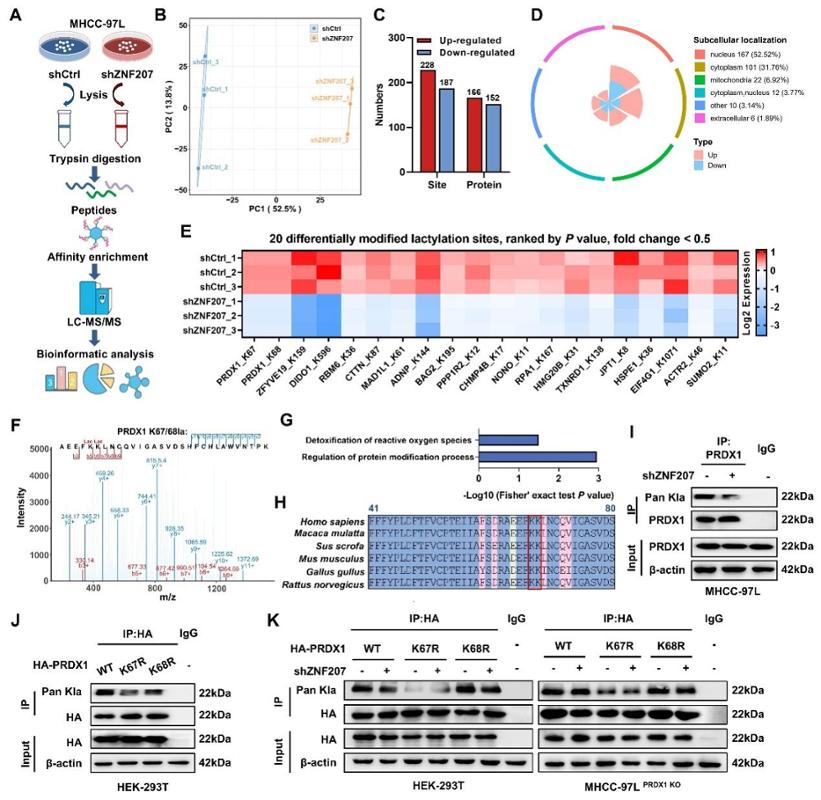
该研究成果近日以《ZNF207通过驱动PRDX1乳酸化和NRF2转录激活介导肝癌瑞戈非尼耐药和铁死亡抵抗》(ZNF207-driven PRDX1 lactylation and NRF2 activation in regorafenib resistance and ferroptosis evasion)为题在国际药学研究领域顶级期刊《药物耐药进展》(Drug Resistance Updates)(IF 21.7)上发表。西安交通大学药学院为本论文的唯一通讯单位,西安交通大学药学院助理教授杨天枫为论文第一作者,西安交通大学药学院张彦民教授为论文的通讯作者。该研究工作得到了国家自然科学基金、陕西省杰出青年科学基金、中国博士后科学基金面上项目的资助。
论文链接:https://www.sciencedirect.com/science/article/pii/S1368764625000779
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...