科学家揭示宿主识别肠道菌群调控免疫新机制
人体肠道内栖息着数万亿微生物,它们不仅协助消化食物,更在免疫系统塑造中扮演关键角色。这些微生物通过释放各类分子与宿主“对话”,调控免疫细胞的生长与功能。为维持肠道微生态平衡,人体配备了黏液层、抗菌蛋白、抗体和补体系统等多重防御工具,以管控菌群活动并抵御有害病原体。但是,一个核心谜题始终未解:在如此复杂的微生物群落中,宿主能否在“茫茫菌海”中选择性识别并管理特定细菌?
中国科学院上海营养与健康研究所钱友存研究组联合分子细胞科学卓越创新中心宋昕阳研究组,揭示了一种宿主与肠道菌群互作的新机制。该研究采用先进的蛋白质组学技术,对比无菌小鼠与普通小鼠的肠道黏膜样本,发现名为APOL9的蛋白在正常小鼠肠道中显著高表达且主要由肠上皮细胞产生。研究通过独创的结合流式细胞术与基因测序(APOL9-seq)技术发现,APOL9及其人类同源蛋白APOL2能够特异性结合一类常见的肠道细菌即拟杆菌目。
进一步,机制研究表明,APOL9的识别能力依赖于细菌表面一种特殊的脂质分子神经酰胺-1-磷酸(Cer1P)。当通过基因编辑去除该分子后,APOL9与细菌不再结合。该研究首次证实,宿主能通过细菌特征性脂质标记,实现选择性“身份识别”。
与传统抗菌蛋白不同,APOL9并不杀死目标细菌,而是诱导其释放外膜囊泡(OMVs)。这些纳米级囊泡满载细菌分子,可被宿主免疫系统捕获并用于增强免疫防御。具体来说,OMVs可以激活干扰素-γ(IFN-γ)信号通路,并提升肠道细胞表面MHC-II分子的表达,从而训练一类特殊的CD4+CD8αα+T细胞,以维持肠道免疫稳态。
为验证APOL9的生理功能,该团队构建了APOL9基因敲除小鼠,并使其感染沙门氏菌。这些小鼠表现出更强的细菌扩散能力和更高的死亡率。而补充APOL9诱导的OMVs后,小鼠感染症状显著改善,免疫应答明显增强。
这一研究首次阐明了宿主蛋白可通过识别细菌脂质标志物并触发有益的免疫反应,揭示了主动塑造菌群的新范式——宿主并非被动容忍微生物而是可以通过主动的分子“对话”实现肠道微生态的动态平衡。同时,该成果有望为开发“菌群-免疫”协同调控的下一代疗法开辟新路径。
5月14日,相关研究成果发表在《自然》(Nature)上。
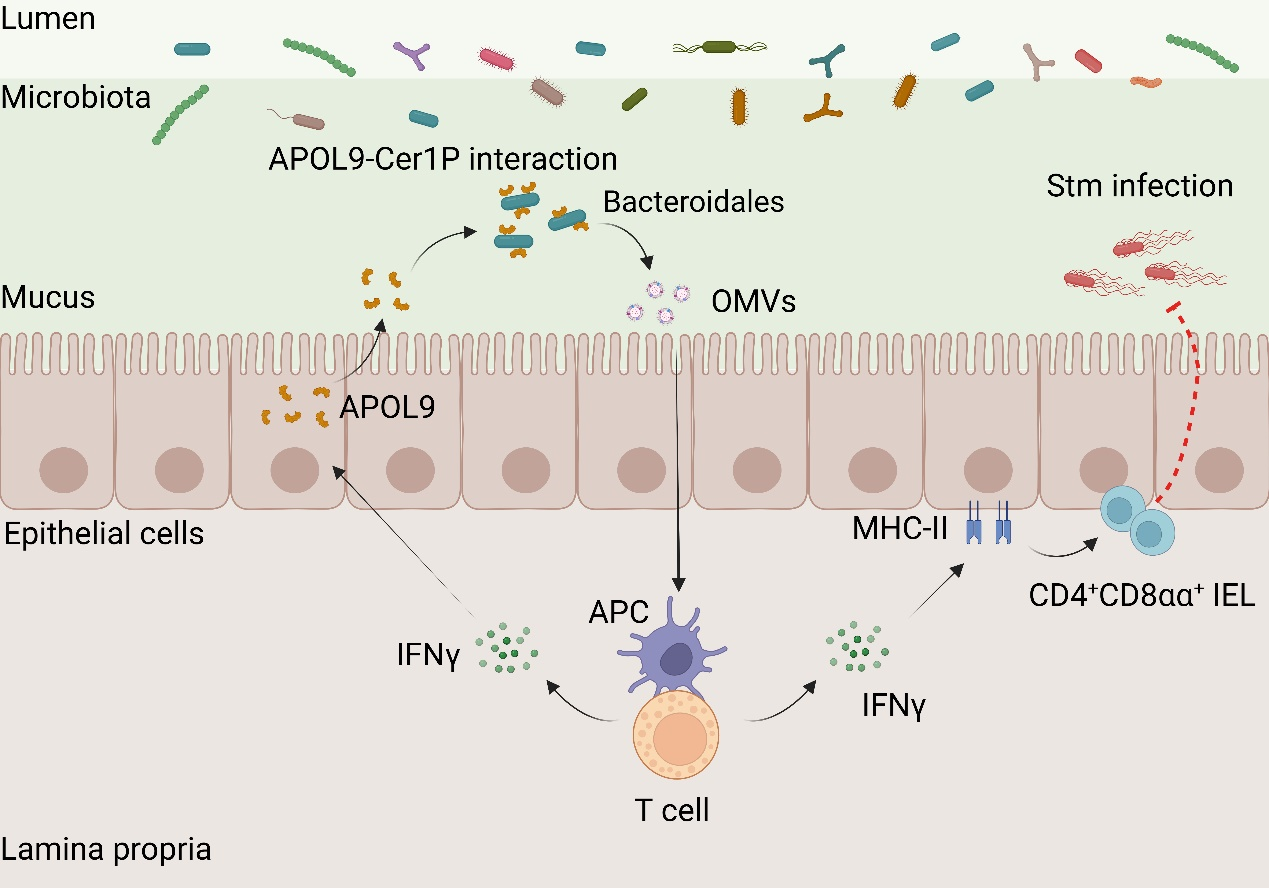
新型载脂蛋白APOL9通过结合拟杆菌Cer1P分子诱导OMVs释放并激活IFN-γ-MHC-II通路以增强肠道黏膜免疫

© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...