研究揭示肿瘤蛋白P63在鳞癌免疫逃逸中的关键作用
近日,中国科学院合肥物质科学研究院健康与医学技术研究所蒋焱熠团队与美国南加州大学De-Chen Lin团队合作发现,鳞状细胞癌(鳞癌)中的主转录因子肿瘤蛋白P63(TP63)通过抑制IFNγ-STAT1信号通路,促进肿瘤的免疫逃逸。研究发现,在小鼠体内模型中,下调TP63表达,增强了PD-1抗体的抗肿瘤免疫疗效。相关研究成果发表在《自然-通讯》(Nature Communications)上。
鳞癌是常见的侵袭性恶性肿瘤,但目前临床治疗缺少有效的靶向治疗方法。近年来,免疫疗法特别是靶向PD-1/PD-L1通路的免疫检查点阻断(ICB)疗法已在鳞癌患者中取得了疗效。然而,仅有少数鳞癌患者从中受益。特别是表现为“免疫冷”表型的患者对ICB疗法不响应或复发。因此,研究鳞癌的免疫逃逸机制,将有助于开发免疫疗效响应性分子标志物和潜在的免疫治疗增效策略。
该研究通过分析鳞癌患者样本、癌细胞系及TP63敲降后的转录数据,观察到TP63的表达对干扰素-γ/α等免疫信号通路产生了抑制作用。进而,研究利用小鼠模型、单细胞RNA测序及体外共培养技术发现,降低TP63的表达能够增加CD8+ T细胞的肿瘤浸润,并强化这些细胞的肿瘤杀伤能力。同时,临床研究数据显示,TP63的表达水平与CD8+ T细胞的浸润和活化程度呈负相关。
进一步,该研究发现下调TP63可以提升PD-1抗体在抗肿瘤免疫治疗中的效果。研究综合运用单细胞转录组学、表观遗传学和生物化学方法,揭示了TP63与STAT1之间存在相互抑制的调控机制。这一机制通过共同调节各自的启动子和增强子以在转录水平上实现相互抑制,二者的相对表达量作为IFNγ信号通路的“开关”,调控下游干扰素刺激基因的表达,进而影响CD8+ T细胞的活性和鳞癌肿瘤的免疫响应。
上述成果揭示了TP63在促进鳞癌细胞逃避免疫监视中的作用,并提出了潜在的免疫治疗增效策略。
研究工作得到国家自然科学基金、分子肿瘤学国家重点实验室开放课题、安徽省自然科学基金和合肥研究院院长基金等的支持。
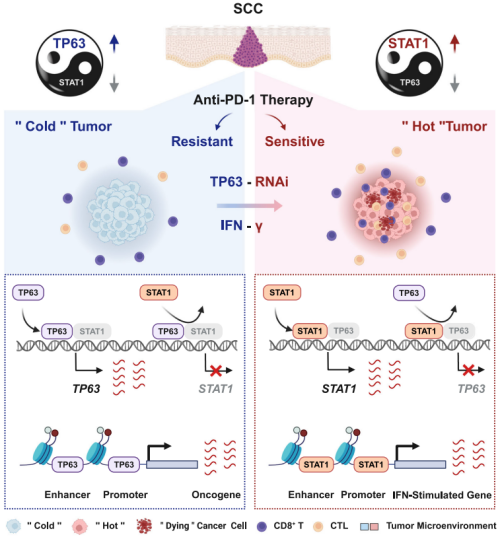
TP63抑制鳞癌免疫应答的模式图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...