天然“诱饵受体”治疗炎症性肠病新机制获揭示
文章导读
肠道炎症为何久治不愈?科学家在人体内发现了一个天然的“灭火队员”。最新研究揭示,一种名为IL-17REL的蛋白,能伪装成“诱饵”,巧妙地拦截并中和引发炎症的关键信号分子,从而有效抑制炎症性肠病的发生发展。这项发表在顶级期刊的发现,不仅解释了部分患者的遗传致病原因,更指出了一个极具潜力的全新药物靶点,为困扰数百万人的慢性肠道疾病带来了革命性的治疗曙光。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,中国科学院上海营养与健康研究所揭示了人源IL-17受体家族新成员IL-17REL在炎症性肠病(IBD)中的保护作用,明确了其在IBD易感性中的关键功能。研究发现,IL-17REL可作为特异性的内源性“诱饵受体”,通过竞争性阻断IL-17家族细胞因子与其经典受体的结合,抑制IL-17信号通路的激活及下游炎症相关基因的表达,进而限制肠道炎症反应并抑制IBD的发生与发展。
该研究分析了IBD患者组织样本,并结合RNA原位杂交和免疫组织化学等手段,首次证实IL17REL可在巨噬细胞、T细胞和B细胞等免疫细胞中被诱导表达,明确了转化生长因子β在其诱导表达中的关键作用。
研究显示,IL-17REL蛋白依赖于ATP-P2RX7-GSDMD通路释放至胞外。胞外IL-17REL以浓度依赖的方式竞争性结合IL-17RA识别的多种IL-17配体成员,从而抑制IL-17信号下游炎症因子基因的表达。同时,人源IL-17REL蛋白与小鼠来源的IL-17A、IL-17C及IL-17F,表现出较强的交叉结合能力。在体内实验中,人源IL17REL基因敲入小鼠,可缓解TNBS诱导的小鼠结肠炎病理表现。
基于遗传学研究发现IL17REL存在两个与IBD相关的单核苷酸多态性突变位点,研究通过功能实验验证了这些突变的致病机制。体外实验表明,突变型IL-17REL蛋白丧失了与IL-17A、IL-17C和IL-17F的结合能力,并失去了对IL-17信号通路的拮抗作用。在体内模型中,携带突变型IL17REL基因的敲入小鼠,完全丧失了野生型IL-17REL在TNBS诱导性结肠炎中的保护效应。研究进一步评估了IL-17REL重组蛋白的治疗潜力。结果显示,系统性给药野生型IL-17REL蛋白能够改善TNBS诱导的小鼠结肠炎,而突变型IL-17REL蛋白不具备治疗效果。
上述研究鉴定并阐明了IL-17家族的诱饵受体IL-17REL,解析了其表达调控机制及免疫功能,并明确其功能性突变是IBD的重要遗传致病因素之一。这为理解IBD的发病机制提供了新的理论框架,也为开发靶向IL-17信号通路的创新治疗策略提供了新的潜在靶点。
相关研究成果发表在《自然-免疫学》(Nature Immunology)上。研究工作得到国家自然科学基金和国家重点研发计划等的支持。
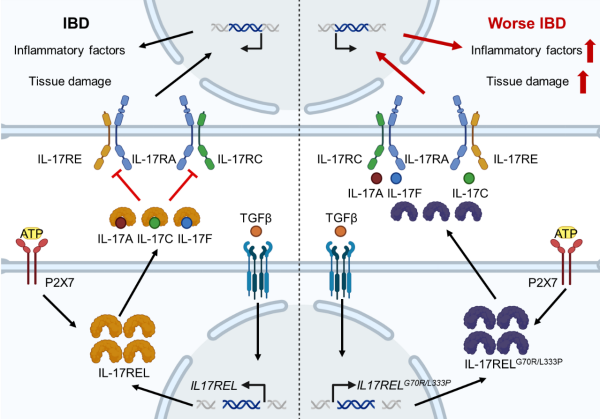
野生型而非突变型IL-17REL蛋白通过竞争性结合IL-17配体成员并抑制下游基因表达,以实现治疗炎症性肠病效果
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。

















hhh终于看到不是IL-23靶点的新思路了,IBD赛道卷出花了
野生型蛋白能系统给药还有效,这递送效率咋解决的?
感觉一般,又是小鼠模型,人身上效果谁知道
说了半天ATP-P2RX7-GSDMD通路,这和焦亡有关系吗?
前几天刚陪家人做肠镜,看到IBD相关内容特别敏感,希望快点转化到临床
突变型完全失效?那基因筛查是不是得跟上啊
IL-17REL要是真能成药,IBD患者就有新希望了,蹲个临床进展🤔
这诱饵受体机制有点意思,比直接抑制通路聪明多了。