文章导读
你是否想过,生物实验室里最普通的“HisTag”蛋白质纯化标签,有一天能摇身一变,成为控制细胞命运的“光之开关”?北京大学研究团队的最新突破,将这一科幻场景变为现实。他们开发的“CAT-tag”技术,仅用一步,就让这个无处不在的小标签与特定催化剂结合,瞬间赋予任何目标蛋白质强大的光催化活性。从精准绘制细胞表面“朋友圈”,到捕捉转瞬即逝的细胞对话,甚至实现光照下的定点抗癌——这项研究正以前所未有的时空精度,为生命科学研究和疾病治疗打开一扇全新的大门。
— 内容由好学术AI分析文章内容生成,仅供参考。
赋予蛋白质非天然的化学反应活性是拓展其化学生物学功能的核心策略。近年来,蛋白质光催化剂偶联物因其独特的生物相容性和高时空分辨率,在邻近标记、细胞生物学研究及前药激活等领域展现出巨大潜力。然而,构建此类系统的传统方法往往依赖复杂的基因密码子扩展技术或非特异性的化学偶联,面临着操作繁琐、位点选择性差或影响蛋白质天然活性等挑战。
组氨酸标签(HisTag)作为重组蛋白表达中最广泛使用的纯化标签,具有分子量小、对蛋白质性质影响小、表达系统兼容性广等优点。目前,仅Addgene数据库中就收录了超过9700个含有HisTag的质粒,HisTag已成为蛋白质科学中最常用的通用元件。然而,尽管HisTag应用极广,其化学潜力却长期局限于单纯的物理亲和纯化。
近日,北京大学化学与分子工程学院陈鹏和樊新元课题组在《美国化学会志》(Journal of the American Chemical Society,JACS)发表题为“Enabling Proteins with Photocatalytic Functions via HisTag–Iridium Coordination”的研究论文。该研究开发了一种简便、通用的蛋白质光催化赋能策略—CAT-tag。该技术巧妙利用蛋白质工程中最通用的HisTag作为金属配体,与无活性的铱催化剂前体进行原位配位组装,一步实现了从“纯化标签”到“光催化中心”的功能跃迁,赋予了蛋白质高效的光催化活性。同时,CAT-tag技术也是其“CAT-X”技术体系中的最新成员,共同构筑了一套生物正交光催化的完备技术矩阵,为生命过程的光催化时空解析提供了强有力的化学工具。

论文截图
科学设计:从“亲和”到“催化”的化学设计
HisTag(通常为6×His)富含咪唑基团。作者受铱光催化剂中联吡啶(bpy)配体的结构启发,利用组氨酸咪唑基团与联吡啶相似的配位特性(sp2杂化氮原子),提出HisTag可作为多齿配体直接锚定铱金属中心的假设。为了实现生物相容性与反应可控性,作者设计并筛选了一系列乙腈配位的铱配合物前体。其中,带有羧基修饰的preIr4表现出最佳的水溶性和反应活性。preIr4在单纯水相中表现出良好的稳定性,且无光催化活性和荧光信号,有效避免了背景干扰。当preIr4与组氨酸咪唑基团配位形成Ir(Im)2结构时,其光物理性质发生显著跃迁,表现出最大发射波长为540nm的强荧光以及高达2.48V的激发态能量。在13种代表性氨基酸竞争测试中,preIr4对组氨酸表现出高度特异的配位选择性。结合动力学研究表明,标准的6×His标签可同时配位3个铱配合物单元,形成稳定的HisTag-Ir3催化中心。
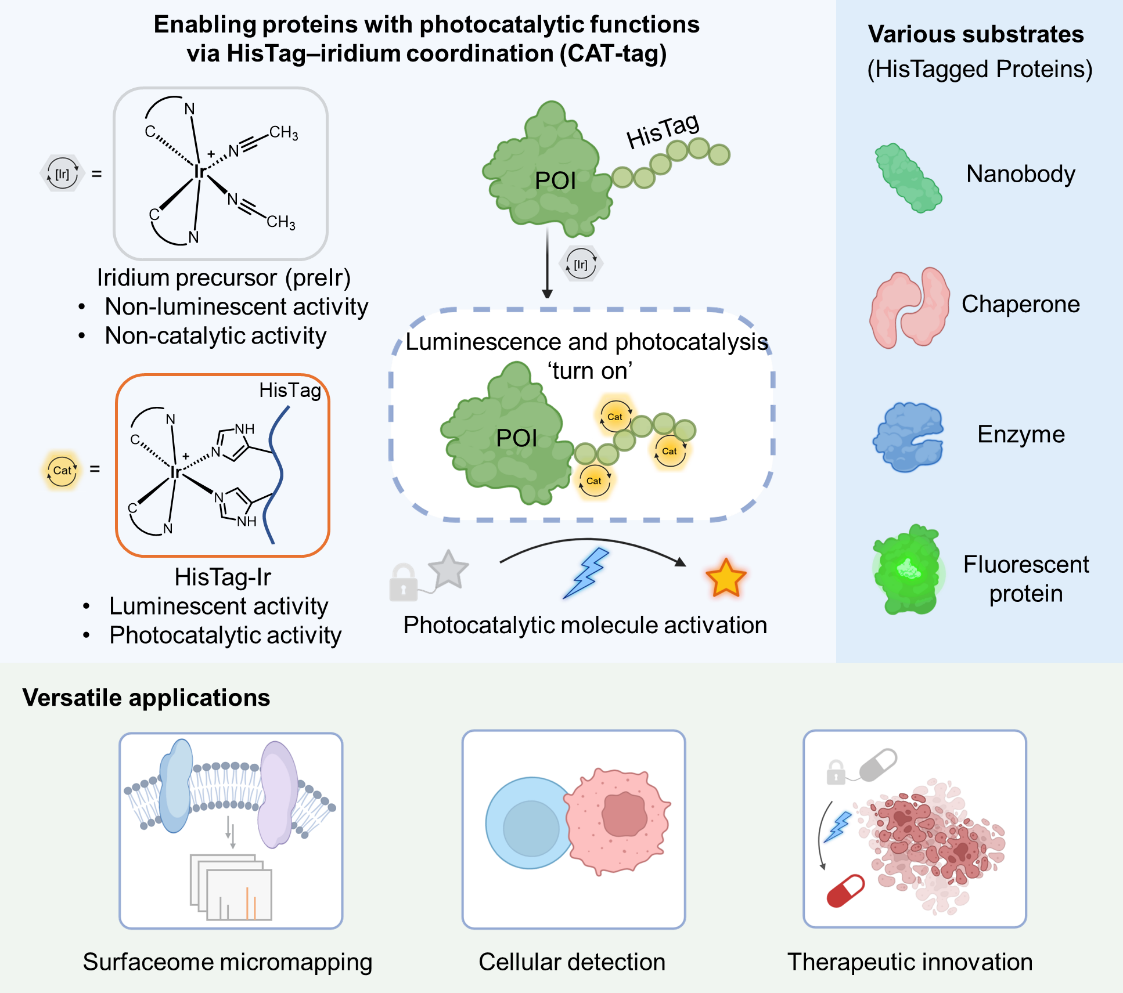
CAT-tag技术的原理与应用
普适性验证:即插即用的光催化模块
随后,作者在多种类型的HisTag融合蛋白上验证了CAT-tag策略的通用性,涵盖了亲和体、纳米抗体、酶、荧光蛋白等不同骨架。这些蛋白质仅需经过标准的HisTag纯化步骤,即可直接与preIr4在PBS缓冲液中(37°C)反应1小时,快速转化为具有荧光和光催化活性的蛋白质-光催化剂偶联物。值得注意的是,即使是FDA批准的双特异性抗体药物Blinatumomab也能通过该策略简便地转化为光催化系统。
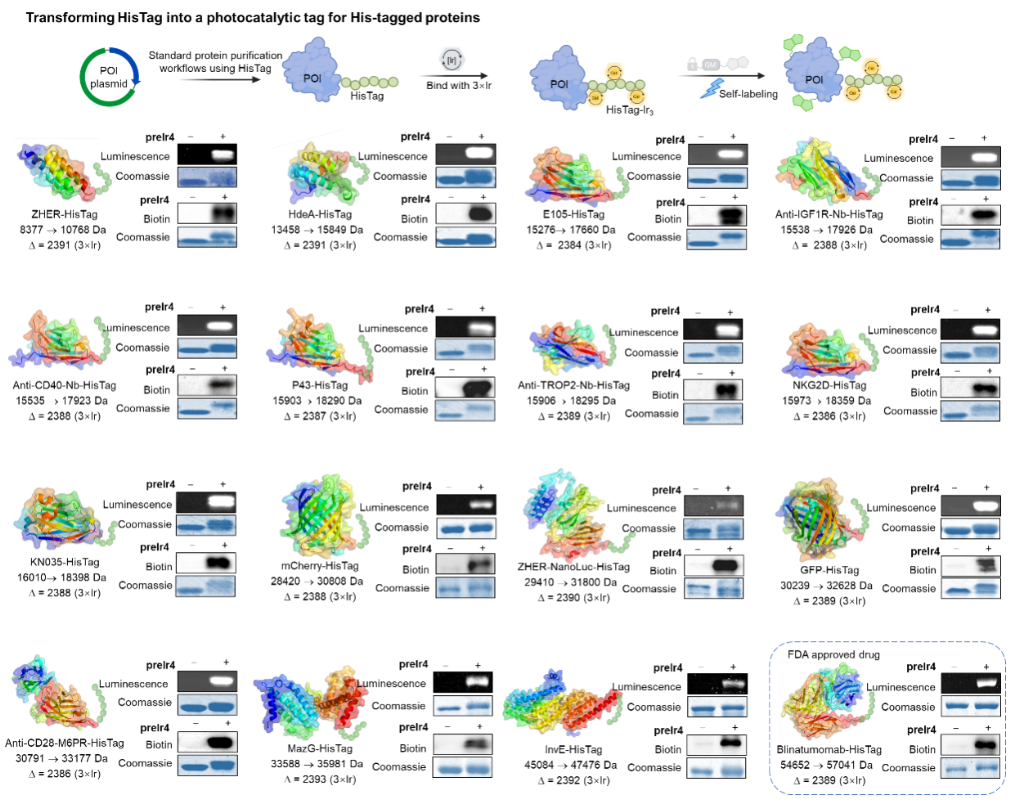
CAT-tag技术的通用性测试
应用场景:三个生物学维度的时空解析与干预
作者在三个生物学维度展示了CAT-tag的应用潜力:
(1)细胞表面组学的“微区”绘制:借鉴其前期开发的CAT-Ex技术(Chem 2022, 2179),利用CAT-tag构建的抗HER2纳米抗体光催化剂(ZHER-HisTag-Ir3),在蓝光激发下通过生物正交反应激活硫代亚甲基醌探针SF2,产生了高活性中间体。该体系成功对HER2阳性细胞表面的邻近微环境进行了精准的生物素化标记,并通过高分辨质谱鉴定了包括离子通道、转运蛋白在内的多种功能性膜蛋白,揭示了HER2受体的膜表面“朋友圈”。
(2)动态细胞相互作用的捕捉:借鉴其前期开发的CAT-Cell和CAT-Tissue技术(J. Am. Chem. Soc. 2024, 15186; J. Am. Chem. Soc. 2025, 9716),针对瞬态的细胞通讯过程,作者利用抗PD-L1纳米抗体构建了CAT-tag光催化探针。在CD40-CD40L介导的细胞互作模型中,该系统能够高选择性地标记与“诱饵”细胞发生相互作用的“猎物”细胞,而对未发生相互作用的细胞无非特异性标记。该结果证明了CAT-tag系统在解析复杂细胞通讯网络中的高信噪比优势。
(3)时空可控的精准前药激活:借鉴其前期开发的CAT-NIR技术(Angew. Chem. Int. Ed. 2023, e202310920.),CAT-tag也能赋予抗体药物“光控杀伤”的新功能。作者合成了一种细胞毒素前药(PAB-MMAE),该前药在单独存在时无毒性,但当被锚定在肿瘤细胞表面的ZHER-HisTag-Ir3催化激活后,可定点释放高活性药物MMAE。实验数据显示,该策略在光照条件下实现了对HER2阳性肿瘤细胞的特异性杀伤,显著降低了对正常细胞的脱靶毒性。
总之,通过精巧的配位化学设计,CAT-tag技术重新定义了HisTag的功能边界,将其从单一的纯化标签升级为可编程的光催化模块。该策略具有“一步组装、位点特异、高度普适”的显著优势,为人工金属酶的设计提供了新的化学范式,也为时空分辨的生物学研究和精准医疗提供了强有力的化学生物学工具。
樊新元和陈鹏为该论文的通讯作者,博士研究生郭昊天和博士后刘子琦为该论文的共同第一作者。该研究工作得到了国家自然科学基金委员会、科技部国家重点研发计划、北京市自然科学基金等项目资金的支持。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















有人说把CAT-tag 用在抗体药物上可以精准释放药物,真的能做到吗?
听说这套系统已经在几家 biotech 里跑通
又是高大上的技术,实验室预算要破产 😂
前几天我用HisTag做酶纯化,正好可以直接上这个法
我觉得光照时间太长会有副作用
这种组装在活细胞里会不会影响蛋白的天然活性?
其实preIr4的水溶性也能兼容其他金属配体,后续可以尝试不同光谱的Ir化合物
HisTag直接变光催化中心,省事高效
这招真挺实用的