研究发现机械力诱导的醛类代谢重塑促进肿瘤转移新机制
文章导读
当癌细胞在体内“挤过”狭窄血管时,一股无形的机械压力正迫使它们开启一套惊人的生存密码。科学家们刚刚破解了这套密码:一种名为ALDH1B1的酶,是癌细胞抵抗挤压、实现远程转移的关键“解毒剂”。这项发表于《自然-通讯》的研究揭示,机械力通过激活特定信号通路,重塑了癌细胞的醛类代谢,使其在严酷的受限环境中免于铁死亡。这不仅解开了肿瘤转移的核心谜团,也为未来开发阻断癌细胞“逃亡之路”的全新疗法指明了方向。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,中国科学院分子细胞科学卓越创新中心等,揭示了在受限环境中,机械挤压力通过诱导醛脱氢酶ALDH1B1介导的醛类代谢重塑,从而维持肿瘤细胞存活并促进其远端转移的分子机制。
肿瘤转移是癌症患者死亡的主要原因,其关键机制在于肿瘤细胞在体内复杂微环境中实现长距离迁移。特别是,当肿瘤细胞穿越狭窄受限空间时,其受限迁移能力决定转移过程能否成功。因此,理解肿瘤细胞在受限条件下的迁移行为,对揭示转移本质及开发干预策略具有重要意义。
代谢重塑是肿瘤发生发展的基础,转移的各个阶段都伴随着特定的代谢适应。然而,在受限的物理微环境中,肿瘤细胞在承受持续性机械挤压时,如何通过动态的代谢重编程来维持能量供应、保障结构完整并实现存活与迁移,其具体分子机制尚不明确。阐明这一“机械—代谢”耦合机制,将为了解肿瘤转移的深层驱动原理提供新视角。
研究运用靶向1685种代谢酶的CRISPR/Cas9体内筛选体系,发现醛脱氢酶ALDH1B1是肿瘤细胞在肺毛细血管内存活的关键因子。机制解析表明,机械挤压促使CSK23与IKKβ激酶相互作用增强,进而诱导IKKβ第177和181位丝氨酸磷酸化,激活NF-κB信号通路,最终上调ALDH1B1的表达。ALDH1B1的上调增强了肿瘤细胞对醛类物质的解毒能力,并通过抑制铁死亡,帮助肿瘤细胞在受限的血管迁移环境中存活,促进肺癌转移。
这一研究揭示了机械力通过重塑醛类代谢调控细胞死亡的新机制,并阐明了该机制在肿瘤转移中的重要功能。这一发现深化了对肿瘤细胞在受限微环境中生存机制的认识,也为开发靶向CSK23或ALDH1B1的抗肿瘤转移策略提供了新方向。
12月14日,相关研究成果在线发表在《自然-通讯》(Nature communications)上。研究工作得到科学技术部、国家自然科学基金委员会、中国科学院等的支持。
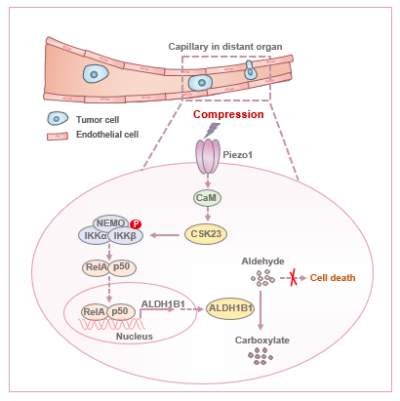
ALDH1B1维持肿瘤细胞在受限空间内存活促进远端定植
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。

















ALDH1B1这靶点有戏,期待后续药物研发进展!
终于明白为啥肿瘤转移这么难搞了,原来醛类代谢是关键!
这研究太硬核了,机械力还能调控代谢?🤯