文章导读
帕金森症患者苦等新解药!当全球数百万家庭被神经退行性疾病阴影笼罩,关键致病基因PINK1的调控密码竟被清华与天大团队一举破解。他们首次通过冷冻电镜捕获Hsp90机器调控PINK1的三大关键瞬间:从CDC37“加载”到FKBP51“折叠”,再到二元复合物成熟全过程,颠覆传统认知。这项《自然·通讯》重磅研究不仅揭示激酶调控的全新分子逻辑,更直接指明帕金森靶向药物研发的新质中的PINK1活性正是突破口。立即深挖机制细节,为神经健康抢夺未来!
— 内容由好学术AI分析文章内容生成,仅供参考。
帕金森症(Parkinson’s disease, PD)是仅次于阿尔茨海默症的全球第二大常见神经退行性疾病。随着全球人口老龄化加剧,帕金森症的发病率逐年升高,对个人及社会都带来重大挑战。帕金森症的病因复杂,遗传因素在其中扮演重要角色。近年来多项研究鉴定出与帕金森症相关的若干基因,其中PINK1(PTEN induced putative kinase 1)尤为关键。PINK1基因突变可导致常染色体隐性遗传的帕金森症,并与多种神经精神症状相关。
12月1日,清华大学生命科学学院/北京生物结构前沿研究中心隋森芳院士课题组与天津大学药物科学与技术学院梅坤荣教授课题组合作在《自然·通讯》(Nature Communications)在线发表题为“Hsp90机器调控PINK1的分子机制”(Molecular mechanism of PINK1 regulation bythe Hsp90 machinery)的研究论文,报道了PINK1与Hsp90及其辅因子CDC37、FKBP51形成的多种复合物结构,为深入理解Hsp90分子伴侣调控激酶的作用机制提供了重要依据。
研究人员通过在293F细胞中过表达人源胞质PINK1,成功获得了其与内源Hsp90、CDC37、FKBP51结合的蛋白复合物。他们进一步利用单颗粒冷冻电镜技术解析了三种复合物结构:分辨率为2.84Å的Hsp90-Cdc37-PINK1复合物、分辨率为6Å的Hsp90-FKBP51-PINK1复合物以及分辨率为2.98Å的Hsp90- PINK1复合物(图1)。
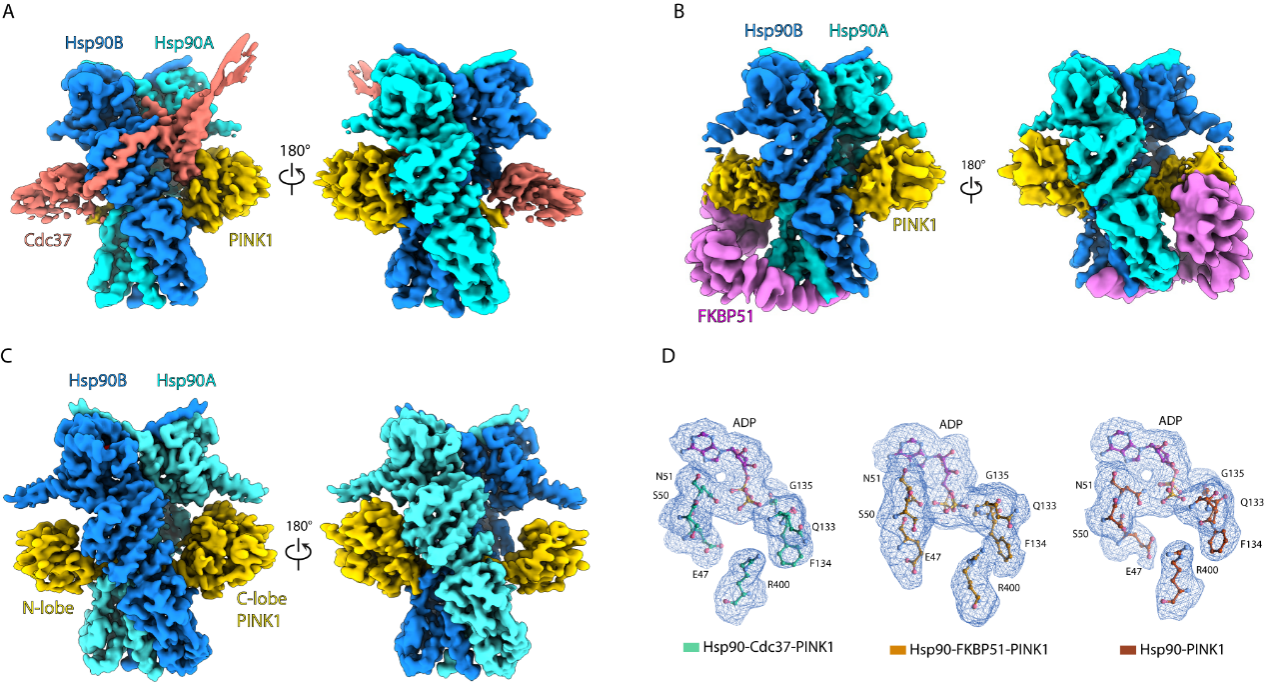
图1.(A)Hsp90-CDC37-PINK1复合物电镜密度图(B)Hsp90-FKBP51-PINK1复合物电镜密度图(C)Hsp90-PINK1复合物电镜密度图(D)复合物中ADP密度图
CDC37能够特异性识别并结合未完全折叠的激酶,将其招募到Hsp90复合物中,因此Hsp90-CDC37-PINK1复合物代表了PINK1的“加载状态”(loading state)(图1A)。FKBP51具有脯氨酸顺反异构酶活性,能够促进蛋白质折叠。该研究首次发现FKBP51能够调控PINK1,形成PINK1处于N端折叠状态(folding state)的Hsp90-FKBP51-PINK1复合物(图1B)。同时,该研究首次捕获到PINK1的N端折叠完成、仅与Hsp90结合而不含其他辅因子的二元复合物Hsp90-PINK1的结构(图1C)。结构分析发现,在解析的三种结构中,内源的Hsp90均结合有ADP,表明闭合构象的Hsp90二聚体形成过程伴随ATP的消耗(图1D)。进一步生化实验发现,Hsp90及其辅因子对PINK1的调控发生在PINK1定位至线粒体、经TOM复合物转运、N端被切除并释放到细胞质之后。值得注意的是,释放到细胞质中的PINK1具有催化活性。通过深入的结构与功能分析,研究团队提出了Hsp90机器调控PINK1成熟的分子模型(图2)。该研究揭示了PINK1蛋白成熟过程的全新调控机制,并补全了Hsp90分子机器在激酶折叠途径中的关键环节,不仅深化了对Hsp90工作机制的理解,也为帕金森症的靶向药物研发提供了新的理论依据。
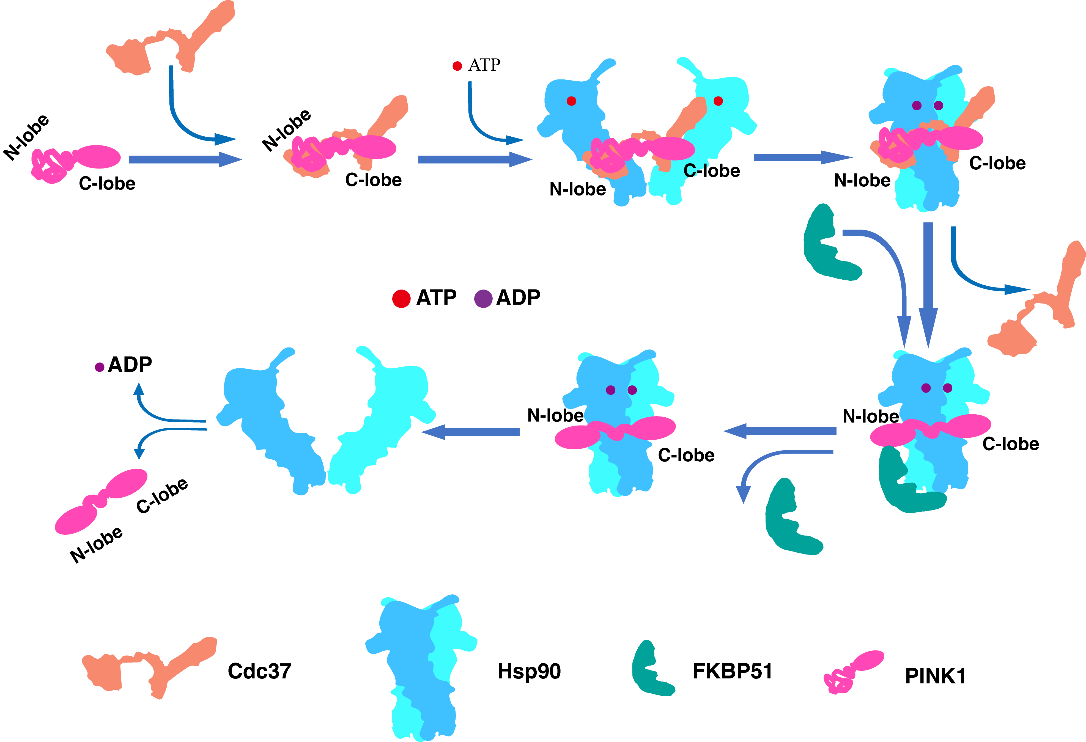
图2. Hsp90机器调控PINK1的模式图
清华大学生命科学学院隋森芳院士和天津大学药物科学与技术学院教授梅坤荣为论文共同通讯作者,清华大学生命科学学院博士后田旭阳、苏家跃(已出站)为论文共同第一作者。
研究得到国家自然科学基金委、北京生物结构前沿研究中心、天津市青年人才托举工程项目等的资金支持,并得到国家蛋白质科学研究(北京)设施清华基地的设施支持。
论文链接:
https://www.nature.com/articles/s41467-025-65859-w
供稿:生命学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















等药等到花儿都谢了,希望别又是“理论可行”啊……
FKBP51居然是首次发现能调控PINK1?这波是新突破吧?
作者太强了,从结构到功能全打通,国产科研之光!
催更一下!这种硬核科研能不能多讲点背后的故事?
话说这冷冻电镜现在真牛,2.8Å都能做,技术党狂喜
笑死,我连题目都念不顺,你们却在讨论机制……吃瓜群众默默路过
不是说PINK1主要在线粒体吗,为啥在胞质里也有活性?
Hsp90还能这样调控PINK1?有点好奇具体怎么作用的🤔
这个研究对帕金森治疗有希望啊,期待后续进展。
太厉害了,清华团队又出重磅成果!👍