南开团队在干细胞全能性激活研究中再获关键突破
文章导读
你是否想过,人类离“人造生命”仅一步之遥?南开大学帅领团队最新研究发现,敲除一个名为Sorcs3的基因,竟能让小鼠胚胎干细胞重获全能性——不仅能发育成胎儿,还能形成胎盘和卵黄囊等胚外组织。更惊人的是,仅用三种小分子抑制剂组合,无需基因编辑即可高效诱导出稳定、安全的全能干细胞,并构建出高度类似天然囊胚的“人工类囊胚”。这项发表于《先进科学》的突破,不仅揭示了Sorcs3是限制干细胞全能性的“刹车”,更提供了两种可规模化获取全能干细胞的新路径,为再生医学、早期胚胎发育研究带来革命性工具。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员 张文豪)近日,南开大学药物化学生物学全国重点实验室的帅领教授团队发现敲除小鼠胚胎干细胞中(ESCs)的 Sorcs3 基因可高效激活干细胞的全能性表型,其背后的机制可能与激活核心转录因子Tfap2c密切相关。进一步研究表明,这些全能性表型的捕获主要通过抑制三条关键信号通路实现,而这一发现对开发有效可靠的全能性培养体系提供全新的思路。相关研究成果发表于期刊《先进科学》(Advanced Science )。
全能性干细胞的捕获和维持是发育生物学的热门研究方向,不仅因其最高的发育潜能可以为胚内胚外的谱系分化提供研究平台,还可以为再生医学研究提供理想的种子细胞。然而,如何高效持续性的在干细胞中激活全能性表型仍然是该领域极富挑战性的工作。
本项研究中,团队成功建立了Sorcs3 敲除(SKO)的小鼠ESCs (SKO-ESCs)细胞系,该干细胞获得了向胚外滋养层干细胞样(TSC-like)以及胚外内胚层样( XEN-like )细胞分化的能力。进一步嵌合结果及单细胞测序表明,SKO-ESCs 极易贡献到胎儿本身以及胎盘和卵黄囊等胚外组织,而敲除其下游关键基因Tfap2c则会严重削弱这种能力。此外,在体外3D培养体系中SKO-ESCs可以高效自组装形成结构、细胞组成与转录组特征均高度类似野生型囊胚的 “人工类囊胚(Blastoids)”。这些类囊胚不仅能在体外培养中发育至类似E6.5阶段的胚胎,还表达着床后关键谱系标志物(如ELF5),为早期胚胎发育研究提供了理想的体外模型。
在单细胞转录组进一步抽提Tfap2c阳性的细胞后进行分析发现,Sorcs3敲除会抑制TGF-β、PI3K-AKT与溶酶体三条关键信号通路,且向野生型ESCs培养基中添加这三条通路的抑制剂组合(SB-431542+LY294002+Vacuolin-1,简称SLV),无需基因编辑即可高效诱导获得全能性:SLV 处理后的 ESCs 不仅能高效形成类囊胚,还可在嵌合体中高效贡献于胚内、胚外组织,且长期培养中保持核型稳定、正常细胞活力,全基因组DNA甲基化水平降至32%(接近全能性细胞特征)。
该研究的突破不仅首次揭示了Sorcs3作为干细胞全能性“限制因子”的全新功能,更建立了两种高效、稳定获取全能干细胞的策略——基因层面的 Sorcs3 敲除与小分子层面的三通路抑制剂组合,前者为解析全能性调控的分子网络提供了理想模型,后者则因操作简便、安全性高,为再生医学领域构建标准化全能干细胞系奠定了基础。
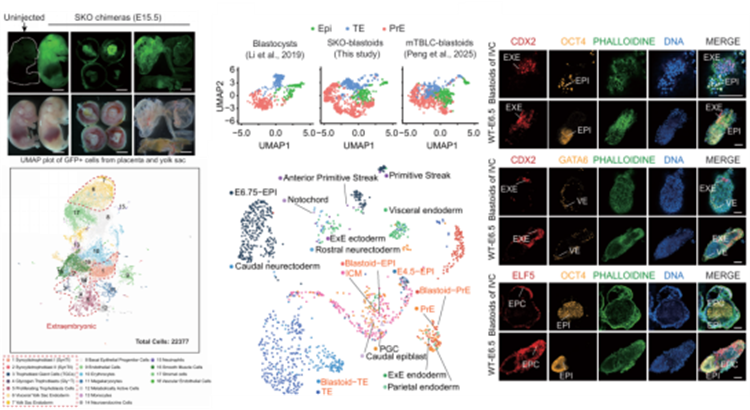
Sorcs3基因在激活干细胞全能性中扮演重要角色
帅领表示:“本研究开发的高质量类囊胚模型,解决了早期胚胎材料稀缺的难题,为探究哺乳动物着床机制、细胞命运决定规律及相关发育疾病研究提供了可靠的工具。这项成果不仅是发育生物学领域的重要突破,更将推动干细胞工程与再生医学向‘模拟完整胚胎发育、实现功能组织再生’的目标迈出关键的一步。”
南开大学副教授张文豪、博士研究生毛欣雨、重庆医科大学儿童医院副教授贺雨为本文共同第一作者,南开大学药物化学生物学全国重点实验室教授帅领、博士高倩,重庆医科大学儿童医院教授史源为该论文的共同通讯作者。该成果受到了国家重点研发计划和国家自然科学基金等多个项目的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...