研究发现WWOX基因胚系失活突变促进甲状腺癌发生发展新机制
文章导读
科学家首次揭示藏在基因里的"甲状腺癌开关"!中科院团队发现WWOX基因胚系突变竟会完全瓦解抑癌功能——当P252A/P282A这两个关键位点失活时,癌细胞将突破双重防线:一方面突变体通过自噬途径被降解,另一方面破坏DNA损伤修复能力,最终激活肿瘤恶性转化。这项发表于《先进科学》的研究不仅破解了25例临床病例中癌症进展的基因密码,更为高风险人群筛查提供了全新靶点。(176字)
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,中国科学院合肥物质科学研究院健康与医学技术研究所/合肥肿瘤医院,联合中国科学技术大学附属第一医院,发现WWOX基因胚系失活突变促进甲状腺癌发生发展。该研究提供了功能机制证据,在机制上连通了WWOX遗传变异与甲状腺癌的临床进程。
WWOX基因位于人类第16号染色体的FRA16D脆性位点,在多种癌症中频繁发生基因缺失,被视为抑癌基因。但是,WWOX基因缺乏典型抑癌基因所应有的功能失活突变的证据。
研究团队通过全外显子组测序,在一例混合性甲状腺癌(未分化癌和乳头状癌)的年轻男性病例中,发现携带WWOX胚系纯合突变。为探讨功能,团队构建了过表达WWOX P252A、P282A单突变和共突变的甲状腺癌细胞模型,通过体外细胞功能分析和小鼠移植瘤实验,发现WWOX P252A、P282A单突变体和共突变体完全失去肿瘤抑制活性,无法抑制肿瘤细胞的生长和侵袭。
团队进一步发现,WWOX的P252A与P282A两种突变体,均丧失其在DNA损伤应答中的关键功能。机制研究显示,P252A与P282A突变均改变WWOX蛋白构象,但通过不同途径失活。具体而言,P252A突变体通过HSC70分子伴侣介导的自噬途径被溶酶体降解,导致抑癌功能丧失;P282A突变破坏WWOX与DNA损伤修复相关蛋白的相互作用。团队剖析25例甲状腺癌临床病例分析发现,WWOX低表达与甲状腺癌上皮-间质转化(EMT)和恶性表型正相关。
该研究发现WWOX胚系失活突变是甲状腺癌的关键驱动因子,其通过削弱DNA损伤修复并激活EMT,促进肿瘤的发生与发展。同时,这一成果研究揭示了WWOX基因在癌症易感性中的重要作用,为甲状腺癌临床风险分层提供了依据。
相关研究成果发表在《先进科学》(Advanced Science)上。研究工作得到国家自然科学基金等的支持。
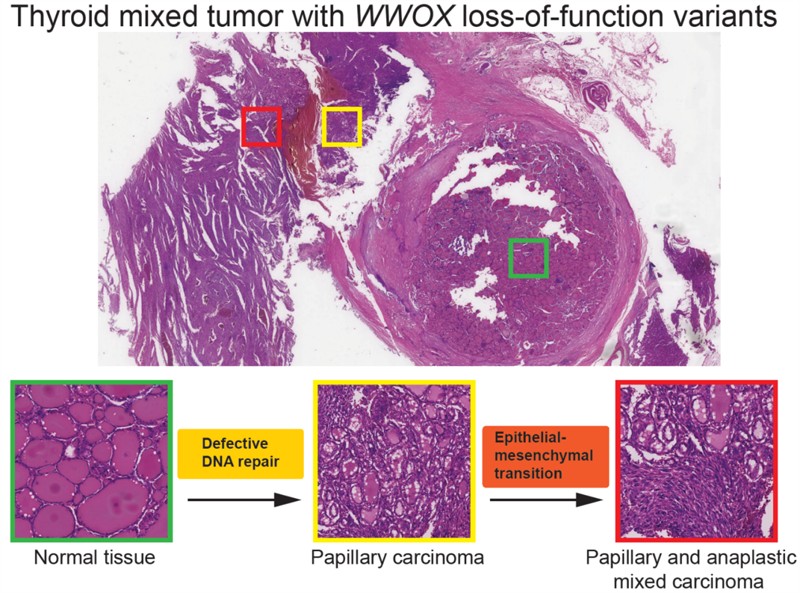
WWOX胚系失活突变是甲状腺癌的关键驱动因子,通过削弱DNA损伤修复并激活EMT,促进肿瘤的发生与发展
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...