研究揭示金属异构酶催化己糖氧化裂解新机制
文章导读
糖代谢的“攻防战”如何上演?次级代谢中鲜有报道的己糖裂解,竟被一种神奇酶玩转双面人生!中国科学院微生物研究所最新研究揭秘:金属异构酶Art22以TIM桶状结构为舞台,先催化己糖异构化“进攻”生成抗菌分子,再通过氧化裂解“防御”清除毒性产物,一气呵成释放CO₂。它颠覆传统认知,在同一催化中心实现动态平衡,不仅拓展了金属酶的反应边界,更揭示了微生物智能调控的分子密码。读完本文,你将掌握这一发表于《自然-催化》的突破机制,洞悉未来抗生素设计的全新逻辑。
— 内容由好学术AI分析文章内容生成,仅供参考。
糖类是细胞能量的主要来源,也是构成细胞结构的重要组成部分。其中,以己糖为代表的分子,通过碳-碳键断裂生成短链化合物,是其进入代谢网络并执行生理功能的重要途径。在初级代谢中,己糖的裂解反应通常通过己酮糖的反向醛缩或类转酮机制实现。然而,在化学多样性相对丰富的次级代谢领域,己糖裂解反应鲜有报道。近期,中国科学院微生物研究所等,解析了一种在次级代谢产物环烯酸菌素生物合成中,可催化己糖碳-碳键氧化裂解的金属异构酶。
环烯酸菌素是一类具有独特6/7/8/5四环结构的多烯聚酮类天然产物,对革兰氏阳性菌表现出显著的抗菌活性。科研人员发现,金属异构酶Art22具有典型的TIM桶状结构,可催化己酮糖异构化反应,并依赖过渡金属离子活化氧气,通过酸酐中间体,实现己糖氧化断裂并伴随CO2释放。同时,Art22可在同一催化中心依次完成异构化与氧化裂解两步反应,并在细菌内发挥双重生理功能,即一方面通过异构化促进杀菌活性分子的生成;另一方面通过氧化裂解作用使微量毒性产物失活,从而实现“进攻”与“防御”的动态平衡。
该研究系统阐明了一种全新的糖类氧化裂解机制,拓展了TIM-桶金属酶的催化反应谱系,揭示了微生物利用同一酶的多重催化活性,实现生理功能智能化调控的分子策略。
相关研究成果发表在《自然-催化》(Nature Catalysis)上。研究工作得到国家自然科学基金委员会、科学技术部、中国科学院等的支持。
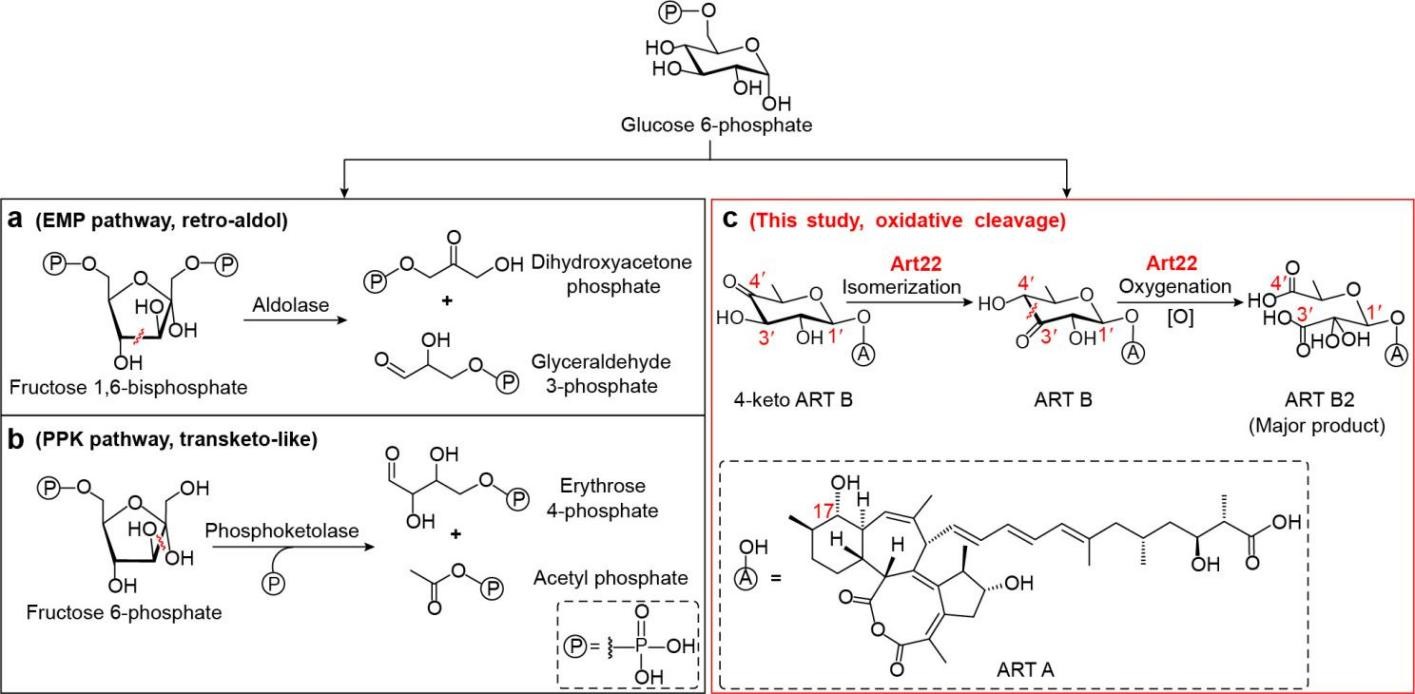
酶催化己糖碳-碳键断裂的不同方式
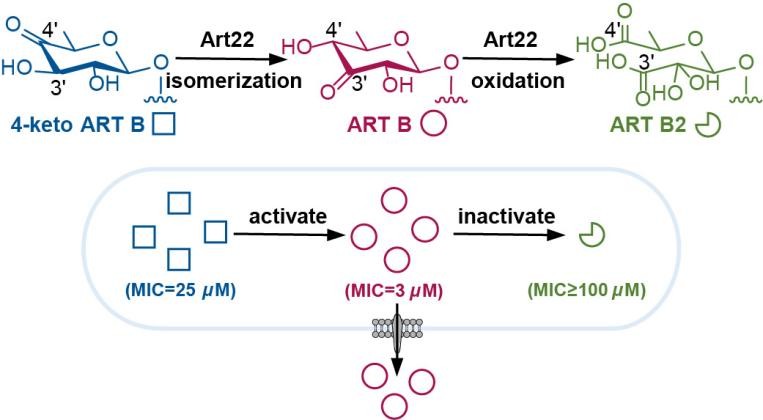
金属酶Art22催化己糖异构和氧化裂解并发挥抗生素激活与解毒功能
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...