研究揭示H3.3丝氨酸31位点磷酸化为转录过程中核小体动力学的分子开关
文章导读
你是否好奇细胞如何在毫秒内启动基因表达?一项突破性研究揭示:H3.3丝氨酸31位点的微小磷酸化修饰,竟是核小体从稳定态转向活化态的关键分子开关!中科院团队通过高精度磁镊技术发现,它动态调控FACT复合物结合,使巨噬细胞在免疫应答中快速重编程转录。更颠覆认知的是,这一开关能精准逆转核小体稳定性,为染色质异常疾病(如癌症)的靶向治疗开辟新路径。180字内读懂细胞响应环境的核心密码,解锁基因调控的隐藏机制。
— 内容由好学术AI分析文章内容生成,仅供参考。
核小体核心颗粒是真核生物染色质的基本单位,由组蛋白八聚体缠绕147 bp DNA,形成左手超螺旋结构。作为DNA加工机制的主要物理屏障,它在几乎所有DNA相关生物过程中起关键作用。
组蛋白变体H3.3与经典H3.2存在四个氨基酸差异,其中N端尾部的丝氨酸31可发生磷酸化修饰。研究表明,H3.3S31ph通过排斥ZMYND11、招募SETD2和p300等机制,动态调控核小体状态与FACT复合物结合,从而在巨噬细胞免疫应答、胚胎干细胞分化及早期胚胎发育中,驱动快速转录重编程。这一修饰作为分子开关,能将H3.3核小体从稳定状态,转化为动态活化构型。然而,H3.3影响核小体稳定性和动态性的具体机制尚不明确。
中国科学院生物物理研究所李伟和首都医科大学基础医学院陈萍团队在研究中,为H3.3及其Ser31磷酸化,如何调控核小体动态性和转录应答提供了新机制见解。
核小体动态结构的精确表征是确定变体H3.3作用的关键一步,研究人员首先通过利用体外核小体组装体系,结合自主建立的高时空分辨单核小体磁镊操控技术,解析了H3.3和FACT对核小体稳定性及结构动力学过程的影响。
研究表明,H3.3不会显著改变核小体的稳定性,但能增强核小体完整性的维持。与经典H3相比,H3.3能更高效地招募FACT复合物,从而抵消FACT核小体的作用。FACT与H3.3核小体的结合会进一步稳定核小体结构,而这一效应可被H3.3第31位丝氨酸磷酸化逆转。
通过全基因组分析,研究人员发现,H3.3的沉积及其Ser31位点磷酸化能动态调控核小体状态,影响FACT结合,并调节巨噬细胞在刺激条件下的转录应答。H3.3S31位点的选择性磷酸化,作为一个关键分子开关,使H3.3核小体从稳定的维持状态,转变为动态的活跃构型。该分子开关使细胞能够快速响应环境刺激,从而促进转录激活。
该研究结合多种技术手段,揭示了组蛋白变体H3.3,如何通过其独特的磷酸化修饰与FACT复合物动态,协同调控巨噬细胞激活的分子机制。H3.3S31ph与FACT复合物的协同作用,在响应环境信号调控染色质状态中发挥核心作用。
该研究将为开发靶向治疗策略提供重要参考,通过调控H3.3磷酸化和FACT功能通路,治疗染色质功能异常相关疾病。
相关研究成果发表在《核酸研究》(Nucleic Acids Research)上。
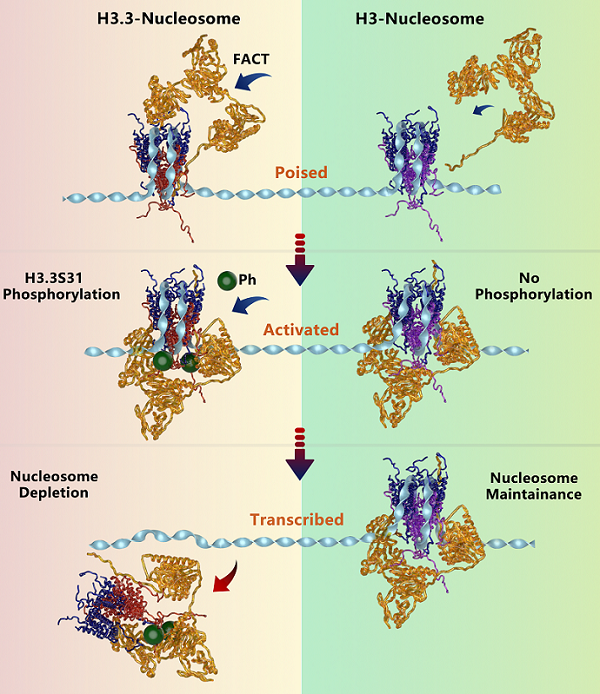
H3.3S31磷酸化可充当分子开关,调控核小体从稳定状态向活化状态的动态转变。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...