东南大学梁高林课题组在《Bioactive Materials》发表最新研究成果
文章导读
如何让光热与化疗精准“合拍”?东南大学梁高林团队提出全新策略,用荧光“点亮”时刻反向推定最佳光照时间,破解传统光热治疗因时机不准导致疗效受限的难题。他们设计了一种可自组装的肽-药物偶联物,在肿瘤细胞内被酶解后释放化疗药并开启荧光,巧妙利用这一“荧光回溯”信号指导光热干预时机。实验证实,该方法显著提升联合治疗效果,为肿瘤精准治疗提供全新路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员 汤润群)近日,国际著名学术期刊《Bioactive Materials》在线发表了东南大学生物科学与医学工程学院/数字医学工程全国重点实验室梁高林教授课题组的研究成果,文章题目为《Timed Photothermal Therapy Combining Fluorescence-On Chemotherapy Maximizes Tumor Treatment》(定时光热疗法联合荧光开启化学疗法最大化地治疗肿瘤)。该项研究首次报道了一种荧光回溯策略以确定光热治疗的最佳光照时刻,实现最大化的肿瘤治疗效果(Bioactive Materials2025, DOI:10.1016/j.bioactmat.2025.07.051)。
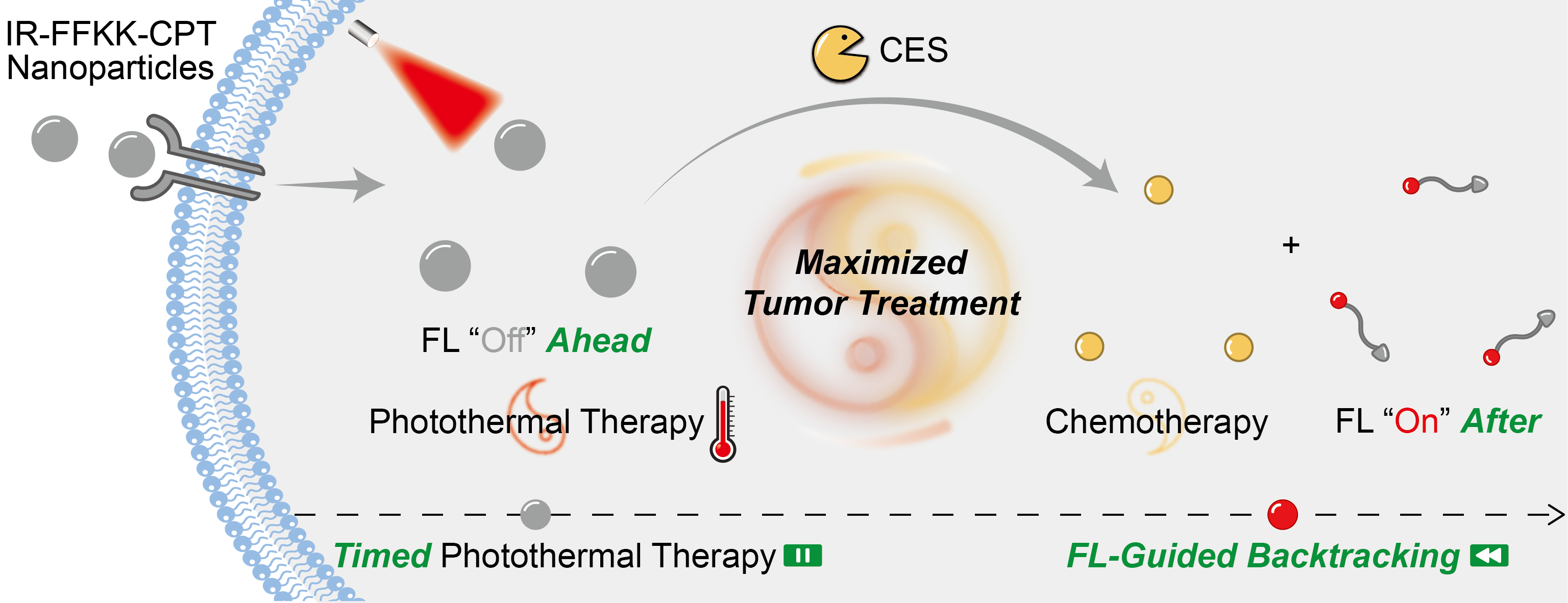
光热疗法联合化学疗法是一种很有前景的肿瘤联合疗法。然而,传统光热治疗往往因光热剂接受激光照射时间的不确定性导致其疗效受限。因此,如何实现上述两种疗法的时空精准协同成为该联合疗法的一个关键科学问题。因此,课题组合理地设计了一种具有自组装性质的肽-药物偶联物IR775-Phe-Phe-Lys(CPT)-Lys(Biotin)-OH(IR-FFKK-CPT)。其中的IR775为光热转换官能团,CPT为化疗药物喜树碱,Biotin(生物素)用于肿瘤靶向。在体外磷酸盐生理缓冲液中,IR-FFKK-CPT自组装成具有高光热转换效率、同时荧光猝灭的纳米粒子。被静脉注射至体内后,纳米粒子在肿瘤的高渗透长滞留(EPR)效应下被癌细胞高效摄取。如下图所示,摄取后的纳米粒子被癌细胞内高表达的羧酸酯酶水解、解组装、释放喜树碱并“点亮”荧光。纳米粒子解组装所“点亮”的荧光显示了化学疗法的开始。但同时说明,如果此时实施光照,已经错过了光热疗法的最佳光照时间点。因为光热剂荧光通道的打开,意味着其激发态电子经产热的内转换通道减少。本研究巧妙地利用纳米粒子荧光“开启”时刻作为指针,精确地回溯到光热治疗的最佳光照时间点。细胞和动物实验表明,这种荧光指导的回溯策略同步了定时光热治疗与可视化化疗,实现了肿瘤联合疗法最大的治疗效果。本研究为科研人员和临床工作者提供了一种颇有前景的肿瘤精准联合疗法。
该论文的第一作者为东南大学生物科学与医学工程学院博士生汤润群。东南大学首席教授/数字医学工程全国重点实验室副主任梁高林为该论文的通讯作者。该工作在国家重点研发计划、国家自然科学基金重点项目以及江苏省前沿引领技术基础研究重大项目等的资助下完成。
论文链接:https://doi.org/10.1016/j.bioactmat.2025.07.051
供稿:生物科学与医学工程学院
(责任编辑:刘明源 审核:李小男)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...