铁自噬受体蛋白NCOA4的调控机制研究取得进展
文章导读
细胞铁稳态失衡竟会引发致命损伤?中国科学院上海有机化学研究所潘李锋团队最新破解了铁自噬核心机制!研究发现,自噬受体蛋白NCOA4能通过[2Fe-2S]簇"感知"铁含量,并以独特双位点模式精准结合E3泛素连接酶HERC2——铁低时NCOA4活跃释放铁储备,铁高时立即被降解防过载。这项发表于《PNAS》的突破,首次揭示细胞避免铁中毒的分子开关,不仅颠覆传统调控认知,更为贫血、神经退行性疾病等靶向药物研发提供关键靶标。15秒读懂:你的细胞如何靠这套精密系统活下来?
— 内容由好学术AI分析文章内容生成,仅供参考。
铁是生命体内不可或缺的微量金属元素,但细胞内铁过量易引发芬顿反应,产生有害的活性氧物种,进而对细胞造成不必要的损伤。因此,维持细胞内铁稳态对于细胞正常运行具有重要意义。在哺乳动物细胞内,多余的铁主要存储在铁蛋白中。自噬受体蛋白NCOA4介导的铁自噬可通过降解细胞内的铁蛋白,释放其中储存的铁,进而提升细胞内的铁水平。同时,为了防止铁自噬过载导致的细胞损伤,细胞内NCOA4的蛋白水平受E3泛素连接酶HERC2的精准调控,但是目前相关的深层次调控机制仍不清楚。
近期,中国科学院上海有机化学研究所研究员潘李锋团队证实铁自噬受体蛋白NCOA4可通过结合[2Fe-2S]簇来感受细胞内的铁水平,并通过解析相关的复合物结构揭示了NCOA4结合[2Fe-2S]簇的分子机制,以及NCOA4通过[2Fe-2S]簇依赖的双位点作用模式来高效结合E3泛素连接酶HERC2的分子机制。
研究团队利用离子交换色谱、紫外–可见光吸收光谱、电子顺磁共振、液体核磁共振等多种实验方法,发现自噬受体蛋白NCOA4识别E3泛素连接酶HERC2的区域,含有一个可结合[2Fe-2S]簇的HBD结构域,该结构域存在结合[2Fe-2S]簇或不结合[2Fe-2S]簇的两种不同状态。该团队进一步利用凝胶共迁移、等温量热滴定和分析型超速离心技术等多种实验方法,详细研究了自噬受体蛋白NCOA4的HBD结构域与HERC2之间的相互作用,发现含有[2Fe-2S]簇的NCOA4采用双位点的作用模式,分别结合HERC2的CPH和INBD结构域,而不含有[2Fe-2S]簇的NCOA4仅通过单位点,微弱地结合HERC2的CPH结构域。上述实验结果表明,NCOA4与HERC2之间的相互作用受[2Fe-2S]簇结合的调控。
研究团队利用X射线单晶衍射技术,解析了HERC2的CPH-INBD区域的单独结构,以及含有[2Fe-2S]簇的NCOA4的HBD结构域与HERC2的CPH-INBD区域的高分辨复合物结构。研究发现NCOA4 HBD的N端区域结合了一分子[2Fe-2S]簇,并介导与HERC2的INBD结构域之间的相互作用,而NCOA4 HBD的C端区域则结合HERC2的CPH结构域。同时,科研人员将解析的复合物结构与HERC2的CPH-INBD单独结构进行叠加比较时发现,HERC2的CPH结构域未发生明显变化,而INBD结构域有非常大的构象翻转,表明NCOA4的结合可能会诱导HERC2发生构象变化,进而促进后续HERC2介导的NCOA4的K48型泛素化修饰的发生。
基于相关的复合物结构分析、点突变生化和细胞生物学实验,研究团队进一步证实了含有[2Fe-2S]簇的NCOA4采用双位点来结合HERC2的独特作用模式,并证实了细胞内HERC2对NCOA4的降解作用,依赖于其CPH和INBD结构域的协同作用。
基于上述发现及此前关于NCOA4介导铁自噬过程的相关报道,该团队提出了一个NCOA4介导铁自噬以及受E3泛素连接酶HERC2调控的作用模型:当细胞内铁含量较低时,铁硫簇的合成也相应减少,此时不含[2Fe-2S]簇的NCOA4不能有效地被HERC2所识别,因此细胞内存在较多的NCOA4,可诱导铁自噬来提升细胞内的铁水平;而当细胞内铁含量较高时,铁硫簇的合成速度加快,促进了NCOA4与[2Fe-2S]簇的结合,此时含有[2Fe-2S]簇的NCOA4能被HERC2高效的识别,并通过泛素–蛋白酶体途径进行降解,从而抑制了NCOA4介导的铁自噬过程发生来防止细胞内铁过载引起的毒副作用。
该研究工作拓展了领域内对于HERC2调控自噬受体蛋白NCOA4介导的铁自噬过程来维持细胞内铁稳态的分子机制的认识,并为靶向铁自噬的药物研发提供了潜在作用靶标。
相关研究成果发表在《美国国家科学院院刊》(PNAS)上。研究工作得到国家自然科学基金、国家重点研发计划、中国科学院青年交叉团队项目等的支持。
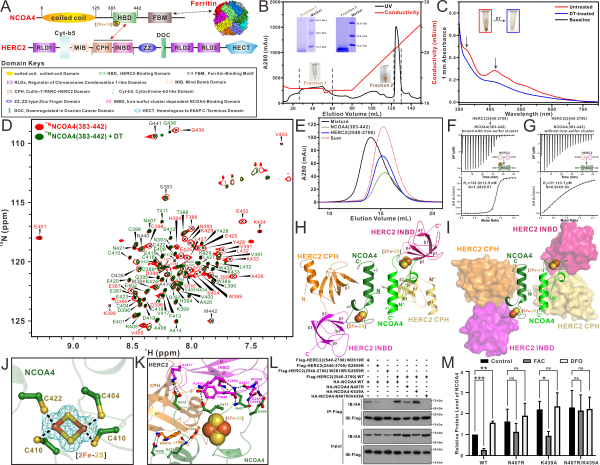
铁自噬受体蛋白NCOA4结合HERC2的分子机制
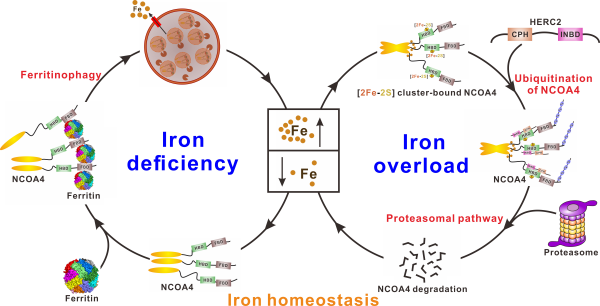
自噬受体蛋白NCOA4介导铁自噬过程及其受HERC2调控的模型示意图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...