文章导读
你是否知道,杀死癌细胞的"隐形利剑"杀鱼菌素竟因合成效率低下被卡在实验室?武汉大学宋恒教授团队用一记王炸破解困局——他们的化学酶平台让杀鱼菌素合成效率狂飙,中试规模产出从克级跃升至克级,且无需重金属污染。这项登上《德国应用化学》封面的技术,不仅用蛋白质工程改造关键酶TleB,更搭建了可生产13种衍生物的"分子工厂",覆盖卵巢癌、肺癌、胰腺癌等治疗靶点。对比传统方法23步的繁琐路线,新方案以5步完成核心结构构建,并成功开发出5个全新分子骨架。当化学手段遇见生物催化,永夜中的科学探索终于为抗肿瘤新药开辟了从实验室到制药车间的黄金甬道。
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员化苑)近日,《德国应用化学》(Angew. Chem. Int. Ed.)发表了武汉大学化学与分子科学学院宋恒课题组关于化学酶平台合成杀鱼菌素家族的最新研究论文,题为“Chemoenzymatic Synthesis and Protein Engineering Enable Efficient, Scalable Production of Teleocidin Derivatives”(化学酶合成与蛋白质工程实现高效、可扩展的杀鱼菌素衍生物制备)。化学与分子科学学院博士后郑硕和博士研究生杨子萱为论文共同第一作者,宋恒教授为论文通讯作者,武汉大学化学与分子科学学院为第一署名单位。
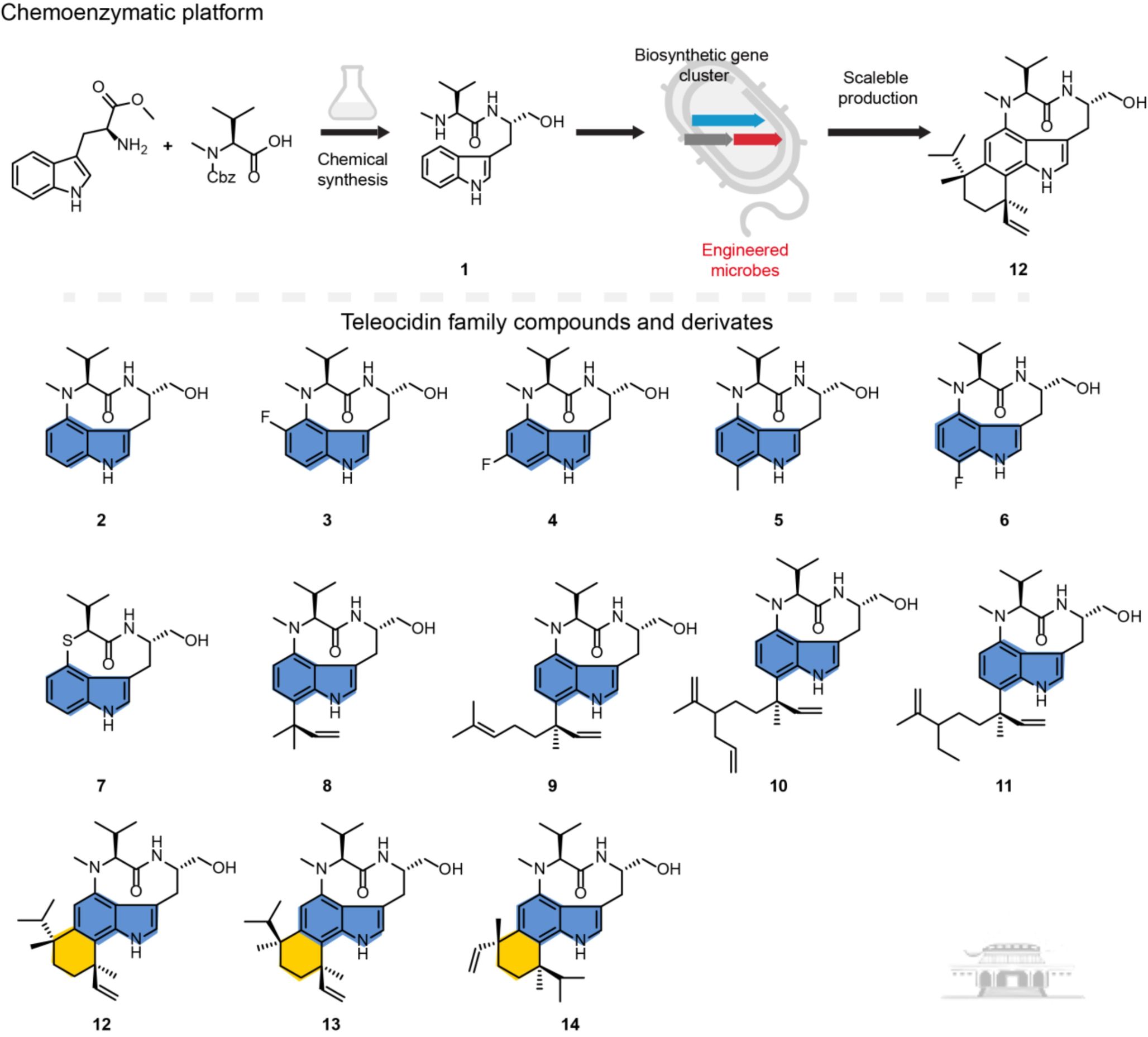
单萜吲哚生物碱家族因其结构多样、生物活性丰富、药物产量高而成为天然药物化学研究的热点。目前已经报道了3000多种单萜吲哚生物碱,其中数十种已被用于临床药物,如长春花碱、喜树碱、奎宁、士的宁等。其中的杀鱼菌素家族是一种含有吲哚稠合九元内酰胺的结构独特的生物碱,在PKC介导的人类疾病机制研究中发挥着关键作用,其可作为有效的蛋白激酶C激活剂从而成为一种潜在的针对结肠癌、胰腺癌、肺癌和卵巢癌等疾病的抗肿瘤药物。
目前,杀鱼菌素的主要合成方法包括天然代谢产物分离提取、化学合成以及生物合成。由于从生物体中提取效率低下,科学家们开发了一系列化学合成方法,涉及电催化、金属催化和有膦配体催化的不对称合成等方法,然而已报道路线存在合成路线繁琐、涉及重金属后处理困难、总收率低和构型异构体分离困难等问题。相比之下,通过使用相应的生物合成酶,可以更好地实现区域和立体化学控制,与传统化学方法形成互补,但是生物合成基因簇中的原生酶的反应效率、实用性和可扩展性往往欠佳。
针对上述挑战,宋恒课题组建立了一个可扩展的化学酶平台,将模块化酶工程与快速化学合成相结合,能够实现高效合成13种结构不同的杀鱼菌素同系物和衍生物。这一策略的核心是通过化学合成快速、大规模地获得NMVT底物后通过生物催化实现关键步骤的高选择性转化。通过蛋白质工程,我们增强了关键酶TleB的催化活性,并建立了一个双菌株共培养系统从而以极高的效率将NMVT转化为杀鱼菌素,最高滴度达到714.7 mg/L。为了进一步证明平台的通用性,宋恒课题组设计了一个单细胞工厂,能够直接生产Indolactam V、Teleocidin A1、Pendolmylcin和Teleocidin B4等一系列化合物。该平台还可用来生产五种新的Indolactam V类似物和两种teleocidin A1衍生物。通过中试规模发酵验证了工业可扩展性,产生了430 mg Indolactam V、170 mg Teleocidin A1和300 mg Teleocidin B衍生物。这些结果将模块化化学酶策略与可扩展的微生物底盘相结合,为高价值天然产物的从头生物合成建立了一个范式,还为复杂单萜吲哚生物碱的可持续工业规模生产勾勒了蓝图。
本研究受到了国家自然科学基金(32370045)、广东省基础与应用基础研究基金(2024A1515011373)和深圳市科技计划(JCYJ20240813111400001)的资助。获得了武汉大学科研公共服务条件平台、化学与分子科学学院大型仪器共享平台的支持。
全文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.202509083
(供图:化学与分子科学学院 编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...