(通讯员药轩)近日,《德国应用化学》(Angewandte Chemie International Edition)在线发表了药学院、泰康生命医学中心教授张帆课题组的研究进展,论文题为“Cytochrome P450 Mediated Cyclohexane Ring Formation in Forazoline Biosynthesis”(《细胞色素P450催化Forazoline中环己烷的生物合成》)。药学院博士生陈心茹和中国科学院天津工业生物技术研究所博士生张玉婕为共同第一作者,张帆和中国科学院天津工业生物技术研究所副研究员苏浩为论文共同通讯作者,武汉大学为第一署名单位。
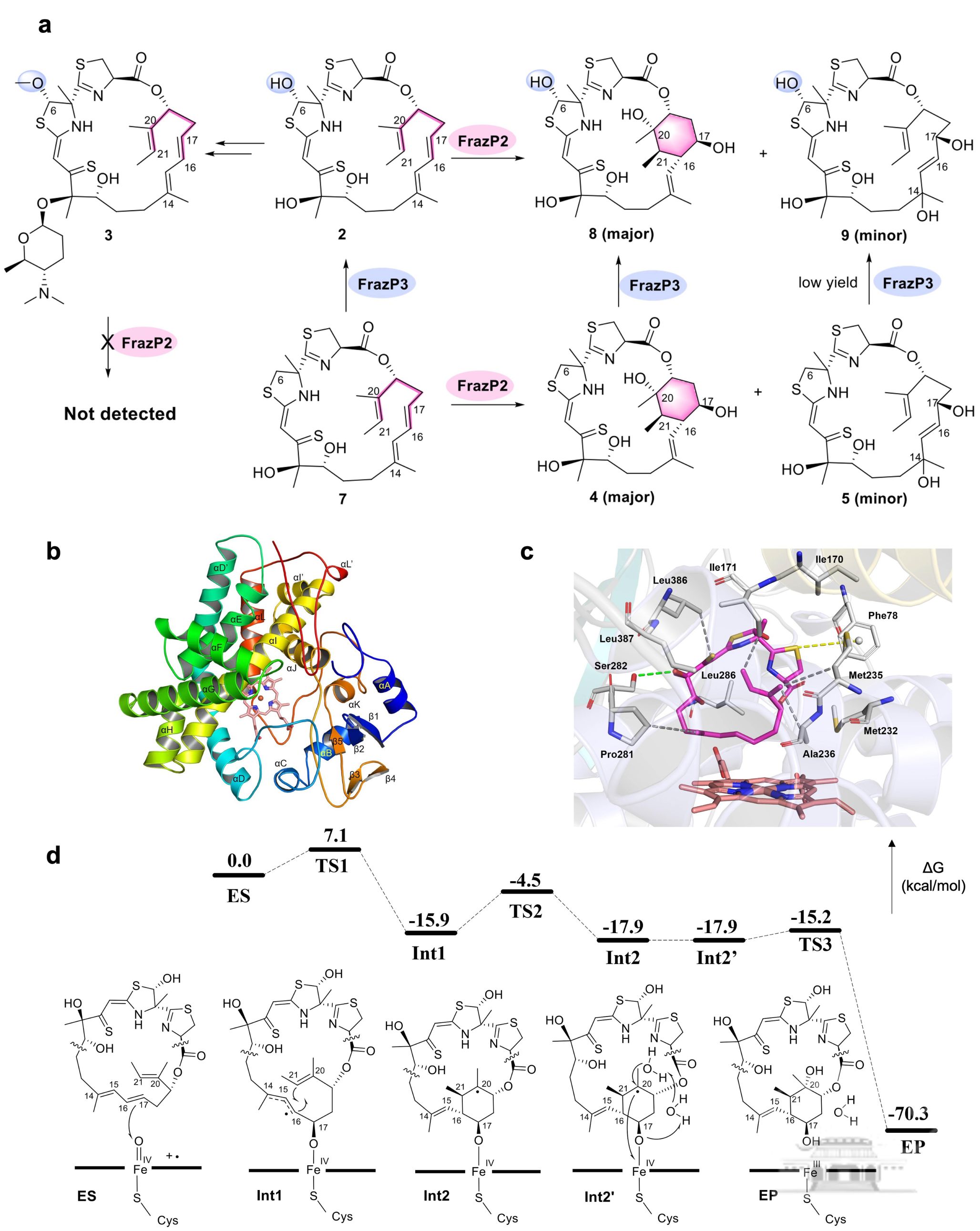
随着多重耐药真菌感染的全球蔓延,开发具有新型作用机制的抗真菌药物已成为迫切需求。Forazoline A是由海洋放线菌Actinomadurasp. WMMB-499产生的聚酮/非核糖体肽(PK/NRP)杂合大环内酯类天然产物,其通过独特作用机制展现显著体内抗真菌活性,有望突破现有药物的耐药性瓶颈。然而,forazoline A复杂的生物合成路径及关键后修饰酶功能长期未被阐明,特别是关键药效基团环己烷的形成机制仍属未解之谜。
张帆课题组通过基因组挖掘锁定候选基因簇,结合异源表达、基因敲除及同位素标记实验,系统解析了三个细胞色素P450酶(FrazP1P2P3)的功能。其中,P450酶FrazP2被证实可催化1,3,6-三烯前体形成环己烷结构,是forazoline A骨架构建的核心步骤。通过解析FrazP2-底物复合物2.3Å高分辨率晶体结构,团队首次捕捉到该酶活性口袋中底物结合的关键构象。结合分子动力学模拟与密度泛函理论计算,研究揭示FrazP2通过”氧化-质子转移-环化”多步协同机制实现非经典环化反应,突破了传统P450酶催化模式的认知。此外,研究团队通过异源表达体系获得系列forazoline开环人工产物,其抗真菌活性较天然产物forazoline A提升4–8倍。这一发现揭示了结构柔性在药物膜渗透性中的关键作用,为新一代抗真菌药物设计提供了重要方向。
该研究得到了国家自然科学基金、国家重点研发计划、武汉大学启动经费、武汉大学泰康生命医学中心的资助和武汉大学科研公共服务条件平台的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202504925
(供图:药学院 编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...