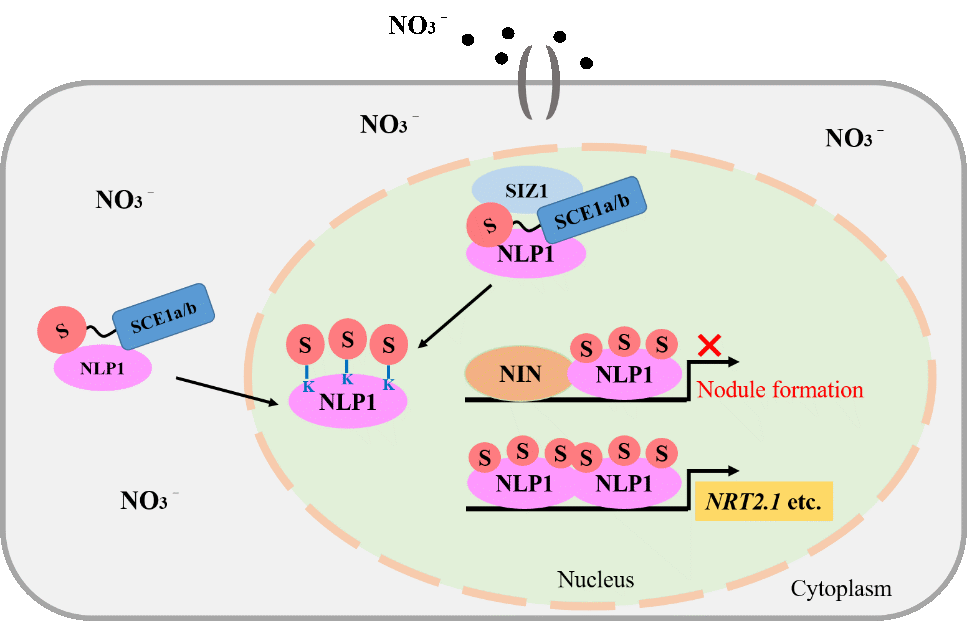
电子科技大学生命学院Benjamin Becker教授/赵伟华副研究员在Advanced Science发文揭示关键神经机制
文章导读
催产素为何只在社交恐惧时起效?最新研究揭秘其“精准调控”背后的神经机制。通过多尺度脑成像,科学家发现它能特异性增强中扣带皮层对杏仁核的抑制,并重构全脑功能网络,显著降低社会性恐惧的主观体验。这一发现不仅揭示了催产素作用的脑区、通路与网络基础,更为社交焦虑等疾病的精准干预提供了关键靶点。想了解催产素如何“定点”缓解社交恐惧?这项来自电子科技大学与深圳大学团队的突破性成果,将为你揭开答案。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,电子科技大学Benjamin Becker教授、赵伟华副研究员,深圳大学梁臻研究员等组成的联合研究团队在国际期刊《Advanced Science》发表题为“Oxytocin Reduces Subjective Fear in Naturalistic Social Contexts via Enhancing Top‐Down Middle Cingulate Amygdala Regulation and Brain‐Wide Fear Representations”的最新研究成果。该研究在“自然社会场景”下,通过双盲安慰剂对照实验、鼻喷催产素干预和多层级功能磁共振成像(fMRI)分析,揭示了催产素缓解社会性恐惧的多尺度神经机制。

社会性情境下,催产素“选择性”减轻主观恐惧体验
研究招募健康男性被试(其中催产素组33人,安慰剂组34人),使用自然主义范式分别诱发“社会性恐惧”和“非社会性恐惧”情绪,并在实验开始前45分钟给予每一名被试鼻喷催产素(24IU)或同等剂量的安慰剂。结果发现,在社会性恐惧情境下,催产素能显著降低个体的主观恐惧评分,而在非社会性情境下并未观察到显著效果(图1)。这一发现提示,催产素的情绪调节作用具有社会情境特异性。
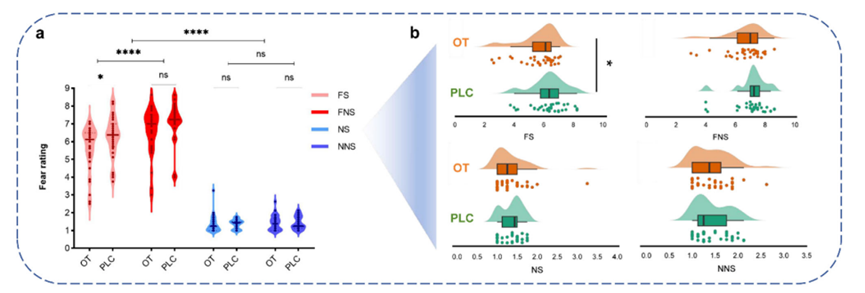
图1 催产素特异性降低社会性恐惧情境下个体主观恐惧评分
中扣带皮层—杏仁核路径是关键神经环路
单变量激活和心理生理交互分析发现,催产素主要增强了左侧中扣带皮层(left middle cingulate cortex,lMCC)的激活强度(图2)及其与右侧杏仁核(right amygdala)之间的功能连接(图3),这一自上而下的调控通路已被广泛认为是情绪抑制的关键神经桥梁。此外,左侧中扣带皮层的激活水平和该通路的连接强度与个体的恐惧评分呈显著负相关(图23),进一步支持了其功能意义。
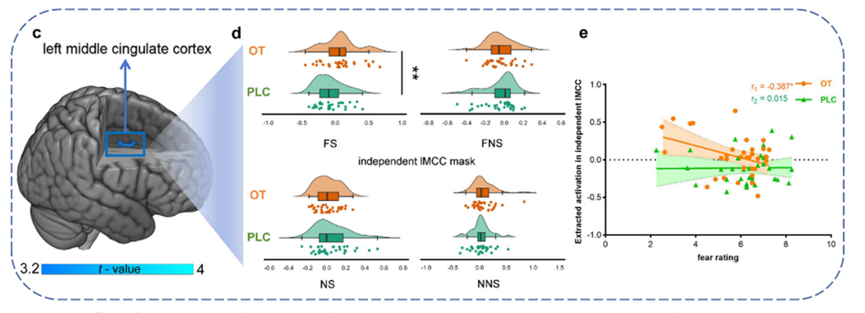
图2 催产素特异性增强社会性恐惧情境下左侧中扣带回皮层激活水平
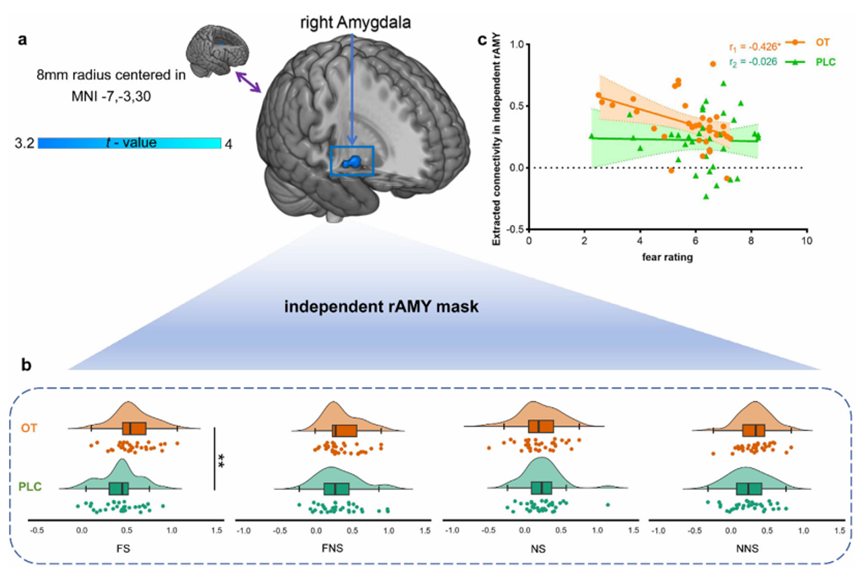
图3 催产素特异性增强社会性恐惧情境下左侧中扣带回-右侧杏仁核功能连接强度
网络耦合重组:从局部到全脑的调节
在大尺度功能网络层面,催产素显著增强了背侧注意网络(dorsal attention network, DAN)、额顶控制网络(fronto-parietal network, FPN)和默认模式网络(default mode network, DMN)之间的协同耦合(图4),促进了全脑范围内广泛分布的脑区间功能连接(图5)。这表明催产素对社会性恐惧的调节效应不仅局限于皮层-边缘结构之间的直接连接,还涉及广泛的网络重组与动态通信,局部到全局的变化共同构成了催产素调节社会性恐惧的网络基础。
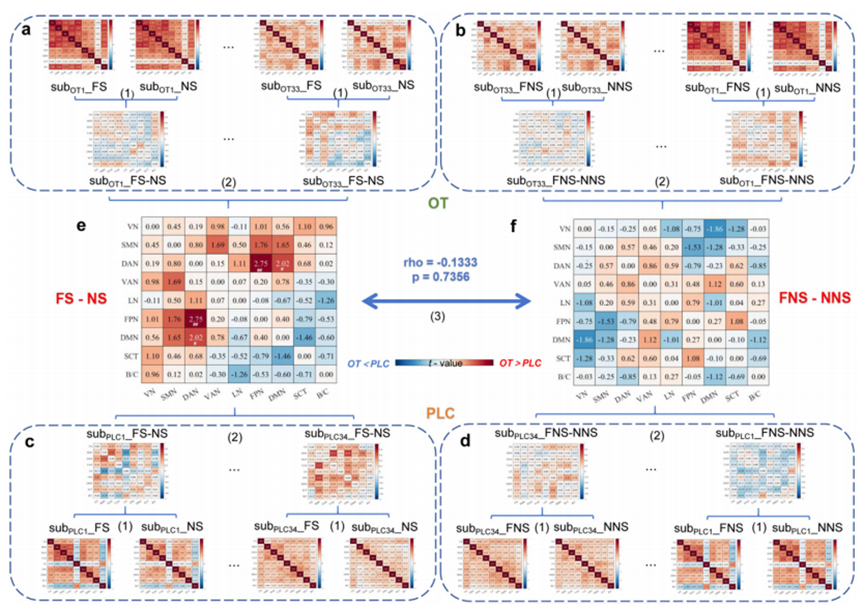
图4 催产素特异性增强社会性恐惧情境下FPN-DAN-DMN大尺度脑网络间信息交换
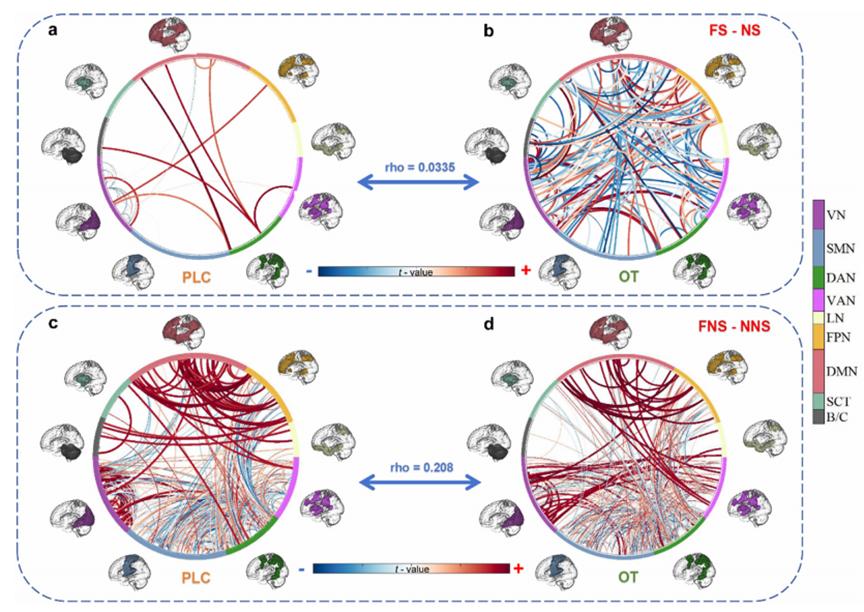
图5 催产素特异性促进社会性恐惧情境下全脑范围内感兴趣区间功能连接
全脑恐惧表征显著下调:独立神经标志物的交叉验证
为验证催产素对恐惧感知的“全脑效应”,研究进一步引入了基于神经活动和连接模式构建的多维恐惧神经标记 – CAFE模型(connectivity and activity-based fear expression, CAFE)。结果显示,催产素显著下调了该模型下的恐惧表达水平,尤其在社会性恐惧条件中效果更为显著(图6),这为催产素的抗恐惧功能提供了全脑尺度的独立支持。
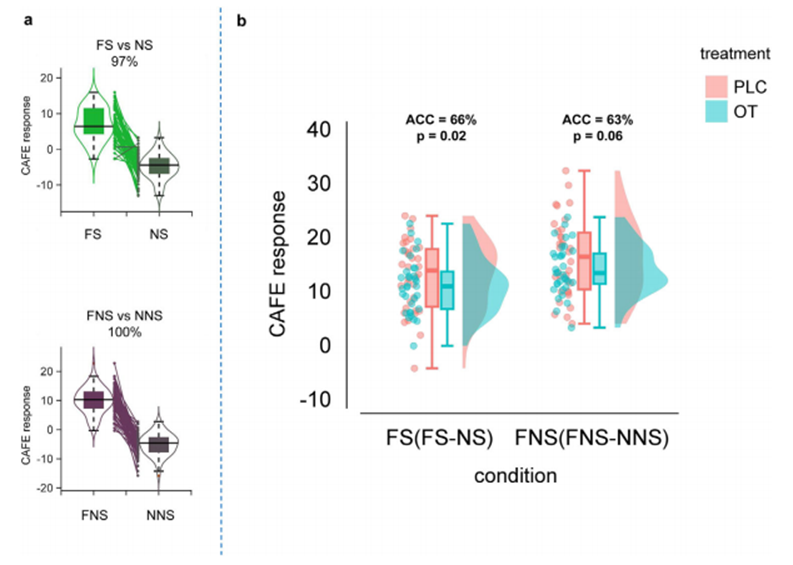
图6 CAFE准确区分社会性非社会性情境下的恐惧刺激和中性刺激,并能特异性地区分社会性恐惧情境下的给药类别
多尺度脑机制 + 社会情境特异性 = 精准干预新靶点
本研究从脑区激活、通路连接到网络重构与表征建模,采用“局部通路—网络耦合—全脑表征”的多尺度神经分析范式,不仅提升了空间覆盖度与机制解释力,也通过多层级交叉验证,精准识别出外源性催产素调控恐惧加工的核心神经通路与脑网络路径。
该工作系统阐明了催产素对社会性恐惧的神经调控机制,为其作为神经药理学干预手段在社交焦虑障碍(social anxiety disorder, SAD)、社交恐惧症(social phobia,SP)等精神疾病中的精准干预奠定了理论基础与机制证据。未来研究将进一步探索催产素在不同人群与临床样本中的适用性,并结合个体化成像和网络预测,推动其向可控、可测的治疗路径转化。
电子科技大学硕士毕业生付坤(现北京协和医学院-电子科技大学联合培养博士研究生)为第一作者,电子科技大学Benjamin Becker教授、赵伟华副研究员与深圳大学梁臻研究员为本文通讯作者。感谢本工作的合作者电子科技大学尧德中教授、Keith M. Kendrick教授、Bharat Biswal教授、兰春梅博士,西南大学周峰教授、许婷副教授,深圳大学徐姝悦,电子科技大学张正、刘丹、张源、张孝东、王俊杰、王岚及何婧娴在数据采集、分析和论文撰写等提供的帮助和宝贵意见。该工作得到了科技创新2030重大计划、国家自然科学基金、科技部2020国家重点研发计划项目、四川省自然科学基金、以及香港大学科研起步基金的资助。
原文链接:https://doi.org/10.1002/advs.202503251
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...