我国学者在活体内细胞间相互作用解析研究方面取得新进展
文章导读
你是否好奇,癌细胞是如何“驯化”免疫细胞为己所用的?我国学者李劼团队突破性开发CINTER-seq技术,首次在活体内精准捕获免疫细胞与癌细胞的实时互作,揭示肿瘤微环境中T细胞、中性粒细胞与癌细胞之间复杂的互动网络。研究发现,LAG3不仅是T细胞耗竭标志,竟还直接介导癌细胞与CD4+ T细胞结合;更惊人的是,肿瘤能通过互作“策反”中性粒细胞,抑制免疫杀伤。这项技术融合近红外催化与单细胞多组学,实现互作强度、转录组与TCR序列的同步解析,为肿瘤免疫治疗提供了全新视角与强大工具。
— 内容由好学术AI分析文章内容生成,仅供参考。
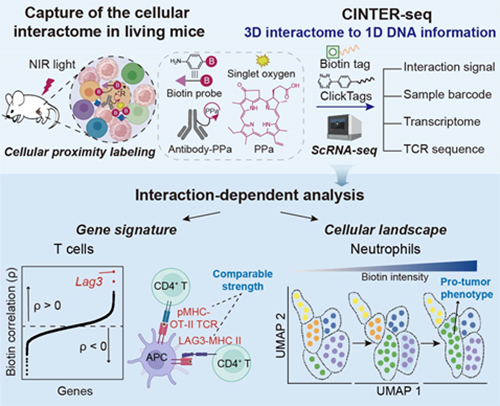
图 CINTER-seq方法揭示细胞互作依赖的细胞景观与基因表达特征
在国家自然科学基金项目(批准号:32350030,32450763,21977048等)资助下,南京大学李劼教授团队在活体内细胞间相互作用解析研究方面取得了新进展,研究成果以“CINTER-seq:化学方法剖析揭示活体内细胞互作依赖的细胞景观与基因表达特征(CINTER-seq: Chemical profiling reveals interaction-dependent cell landscapes and gene signatures in vivo)”为题,于2025年7月16日在线发表于《免疫》(Immunity)。论文链接:https://www.cell.com/immunity/fulltext/S1074-7613(25)00280-8。
细胞间的相互作用在调控机体生理功能和疾病进程中发挥着关键作用。相比体外研究模型,活体原位研究更能真实反映细胞互作的自然状态,但技术要求也更为严苛。然而,在活体内原位解析细胞间的相互作用仍面临较大技术挑战,现有研究工具相对匮乏。目前常用的活体互作研究手段主要包括以双光子显微成像为代表的成像技术,以及以uLIPSTIC为代表的酶催化邻近标记方法,但仍存在一定的应用局限。
李劼教授团队率先开发出了基于近红外光催化的活体原位邻近标记技术(NIR-PPL),以天然卟啉骨架分子焦脱镁叶绿酸a(PPa)为催化剂,结合高效的苯胺基生物素探针(BAn),实现在活体状态下精准捕获免疫细胞与癌细胞之间物理接触的相互作用。研究团队进一步融合单细胞多组学技术,构建了名为CINTER-seq的高通量细胞互作定量分析平台,在单细胞水平上实现了细胞转录组、T细胞受体(TCR)序列、样本来源信息以及细胞间相互作用强度的同步整合分析,揭示了肿瘤微环境中T细胞及中性粒细胞与癌细胞在互作强度上的细胞景观与基因表达特征(图)。研究发现免疫检查点分子LAG3不仅是细胞耗竭的标志物,还可直接介导肿瘤细胞与CD4+ T细胞的相互作用。同时,研究也揭示了肿瘤细胞可通过互作“驯化”中性粒细胞使其表现为促进肿瘤进展的表型,并通过抑制T细胞增殖及杀伤能力,削弱其抗肿瘤免疫效应。
该研究为深入解析活体细胞互作网络及其在肿瘤等重大疾病中的作用机制提供了高效、精准的新工具,为肿瘤免疫治疗研究提供了重要的理论和技术支撑。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...