大连理工大学生物工程学院科研团队在基因编辑与合成生物学领域取得重要进展
文章导读
基因编辑效率低、干扰多?大连理工大学科研团队研发出一项颠覆性策略——SELECT。它巧妙融合CRISPR-Cas与DNA损伤应答机制,不仅将编辑效率提升4倍以上,还能精准区分编辑与未编辑菌株,助力高通量文库构建与表型-基因型关联分析。这项成果已在《核酸研究》发表,跨物种测试显示同样高效,为合成生物学和AI辅助设计开辟了新的可能。你想知道它是如何实现精准改造和数据驱动的突破吗?答案都在这篇文章里。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,生物工程学院智能生物制造教育部重点实验室基因编辑与合成生物工程课题组刘嵘明教授与梁丽亚副教授团队在生化与分子生物学领域国际权威Top期刊《核酸研究》(Nucleic Acids Research)发表题为基于“CRISPR-Cas与DNA损伤应答协同作用的高精度基因组编辑策略及其跨物种应用”(SELECT:high-precision genome editing strategy via integration of CRISPR-Cas and DNA damage response for cross-species applications)的文章。我校生物工程学院为第一单位。刘嵘明、梁丽亚为本文的通讯作者。生物工程学院硕士研究生刘筱航与在读博士研究生谭慧萍为共同第一作者。
CRISPR-Cas系统是目前基因组工程中最常用的工具,广泛应用于基因组编辑和菌株代谢工程改造。但其最关键的参数——编辑效率,常受到目标序列、宿主背景及迭代编辑轮次等因素的影响。低编辑效率不仅会导致高通量文库编辑基因组时难以获得期望的突变体,还会影响高通量编辑后的表型-基因型关联的精确追踪,这些问题严重制约了大规模精准代谢工程与人工智能辅助设计的应用。
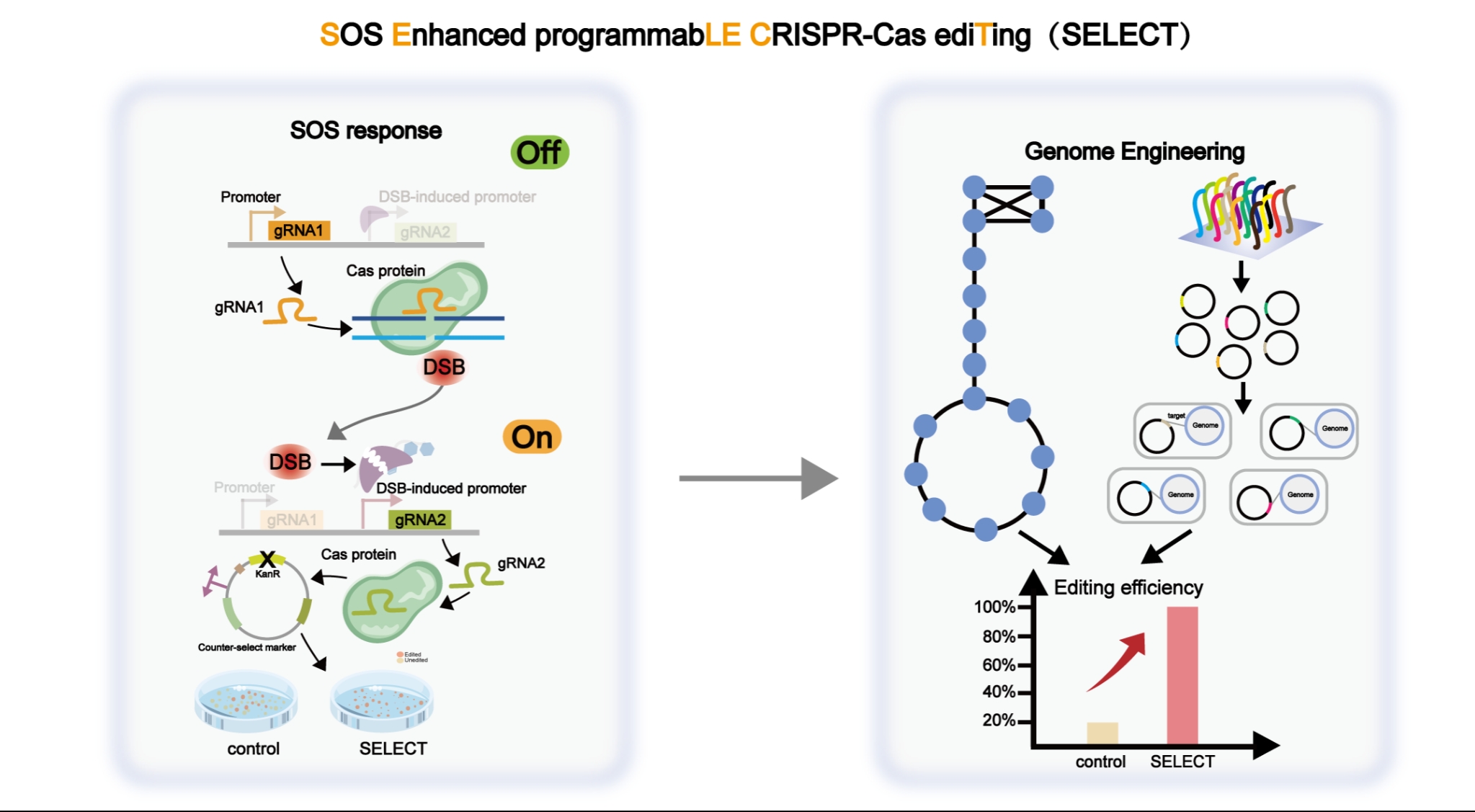
该文章介绍了一种全新的精准基因组编辑策略SELECT:基于SOS响应的可编程CRISPR-Cas基因组编辑策略(SOS Enhanced programmabLE CRISPR-Caseditingstrategy)。SELECT方法巧妙地将CRISPR-Cas介导的DNA双链断裂(DSBs)与宿主DNA损伤响应机制(如大肠杆菌中的SOS反应或酿酒酵母中细胞周期检查点)相结合,构建了一套由DSB响应型启动子介导的反向筛选系统。该系统通过是否发生双链断裂来区分编辑及未编辑菌株,并利用反向筛选单元去除未编辑细胞,最终在基因失活、插入、迭代改造以及高通量基因组编辑等不同场景中实现了高效抗干扰基因编辑。以淡黄霉素(flaviolin)为例,使用SELECT方法进行高通量突变文库构建,不同文库编辑效率均高于80%,较CREATE等方法相比,整体编辑效率提升了4倍以上,结合高通量筛选及示踪标签快速定位,获得了产量提升3.97倍的突变菌株。同时,高质量表型-基因型数据通过机器学习算法可成功预测特定突变对目标产物的影响,建立了精准的基因序列特征与产量表型之间的映射关系。此外,该研究将SELECT策略拓展到以酿酒酵母为代表的真核生物宿主中,同样实现了显著的基因组编辑效率提升,展现出跨物种的适用性。
SELECT方法突破了传统CRISPR-Cas方法在复杂基因组编辑任务中的性能瓶颈,具有高效率、高精度、高通量和跨物种通用的特点,为精准代谢工程和基因组修饰提供了全新策略,也为AI辅助合成生物学设计提供了高质量的数据集与创新方案。
本研究得到了国家重点研发计划、国家自然科学基金、“兴辽英才计划”项目、辽宁省自然科学基金、大连市科技创新基金项目以及大工基础研究基金的支持。
原文链接:https://doi.org/10.1093/nar/gkaf595
来源:生物工程学院
编辑:罗一铭 常思萌
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...