(通讯员唐晖)近日,武汉大学化学与分子科学学院唐宏武教授团队在ACS Nano发表两篇研究论文,分别为“Optical trapping of a single virus in a host cell based on active-passive calibration for trap stiffness”“Optical Tweezer-Driven Mechanotransduction: Probing pN-Scale Forces and Calcium-Mediated Redox Signaling in Single Endothelial Cells”。
2021级博士研究生徐大地为第一篇论文的第一作者,2022级博士研究生李煜垚和高等研究院博士生李浩冬为第二篇论文的共同第一作者。武汉大学为论文署名单位和通讯作者单位,唐宏武为论文通讯作者。
在国家重大科研仪器研制项目的资助下,唐宏武课题组成功研制“用于活细胞内单颗粒示踪和实时操纵的光镊显微镜”,该仪器项目于2024年初正式结题并通过验收汇报。上述成果就是采用该仪器完成的。
光镊技术虽能用于微小粒子的捕获,但捕获纳米尺度的病毒粒子极为困难,特别是在宿主细胞的粘弹性环境中,通过对病毒粒子的捕获实现力学参数的精准测量是一大科学难题。该团队成功利用光镊技术实现活细胞内单病毒的精准捕获与力学测量,提出“主动-被动校正法”,攻克了细胞内复杂环境对病毒力学参数测量的干扰这一难题,为病毒侵染机制研究提供了全新工具。他们将被动校正(分析病毒受布朗运动影响的相对位置信息)和主动校正(施加正弦振荡力,采集病毒和载物台信号)结合起来,成功实现了细胞内病毒光阱刚度的校正。该技术不仅实现了国际上首次活细胞内病毒的捕获,同时还能实现其光阱刚度和粘弹性模量的原位测定。以上成果不仅为纳米尺度生物颗粒的力学研究提供了新方法,更展示了光镊技术在病毒研究中的独特优势,为发展抗病毒策略提供了新思路。
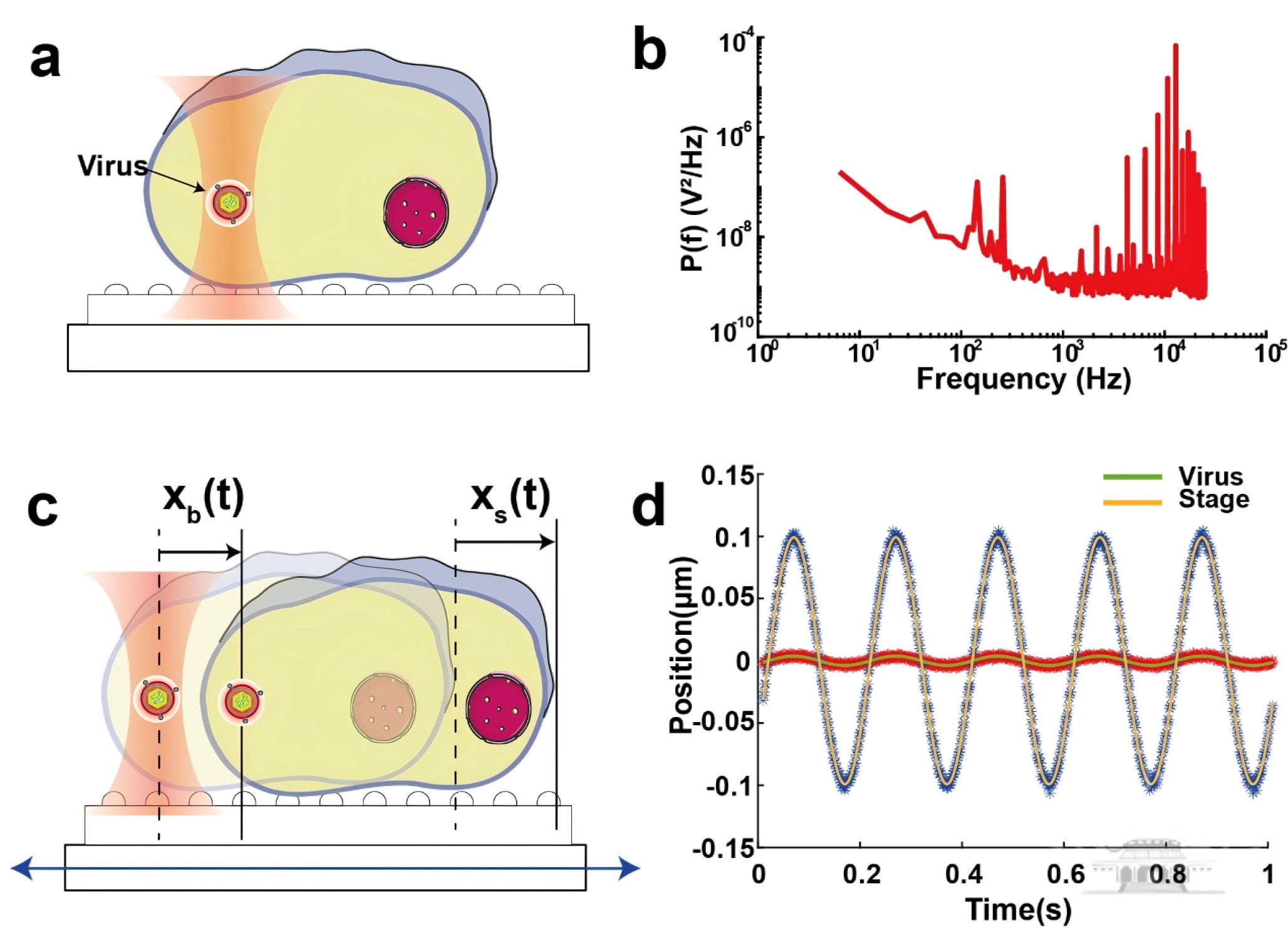
主动-被动校正法校正细胞内病毒光阱刚度(图片来自原文)
该团队以精准、无损操纵细胞膜受pN级力学刺激,同时系统地检测了不同力幅、脉冲数和频率下对单个内皮细胞Ca²⁺介导的NO/ROS氧化还原信号的机械敏感性。通过光镊的pN级机械刺激首先调节细胞外Ca²⁺的内流,从而引发下游NO和ROS的产生,进一步影响胞内的氧化还原稳态。关键的机械敏感性离子通道(如Piezo1、TRPV4)和细胞骨架成分(如F-肌动蛋白)促进了力诱导的氧化还原信号转导。最后,构建膜张力主导模型和混合张力-系绳模型直接探究pN级力响应机制,建立了pN级机械输入与氧化还原调节的血管稳态之间的直接联系。
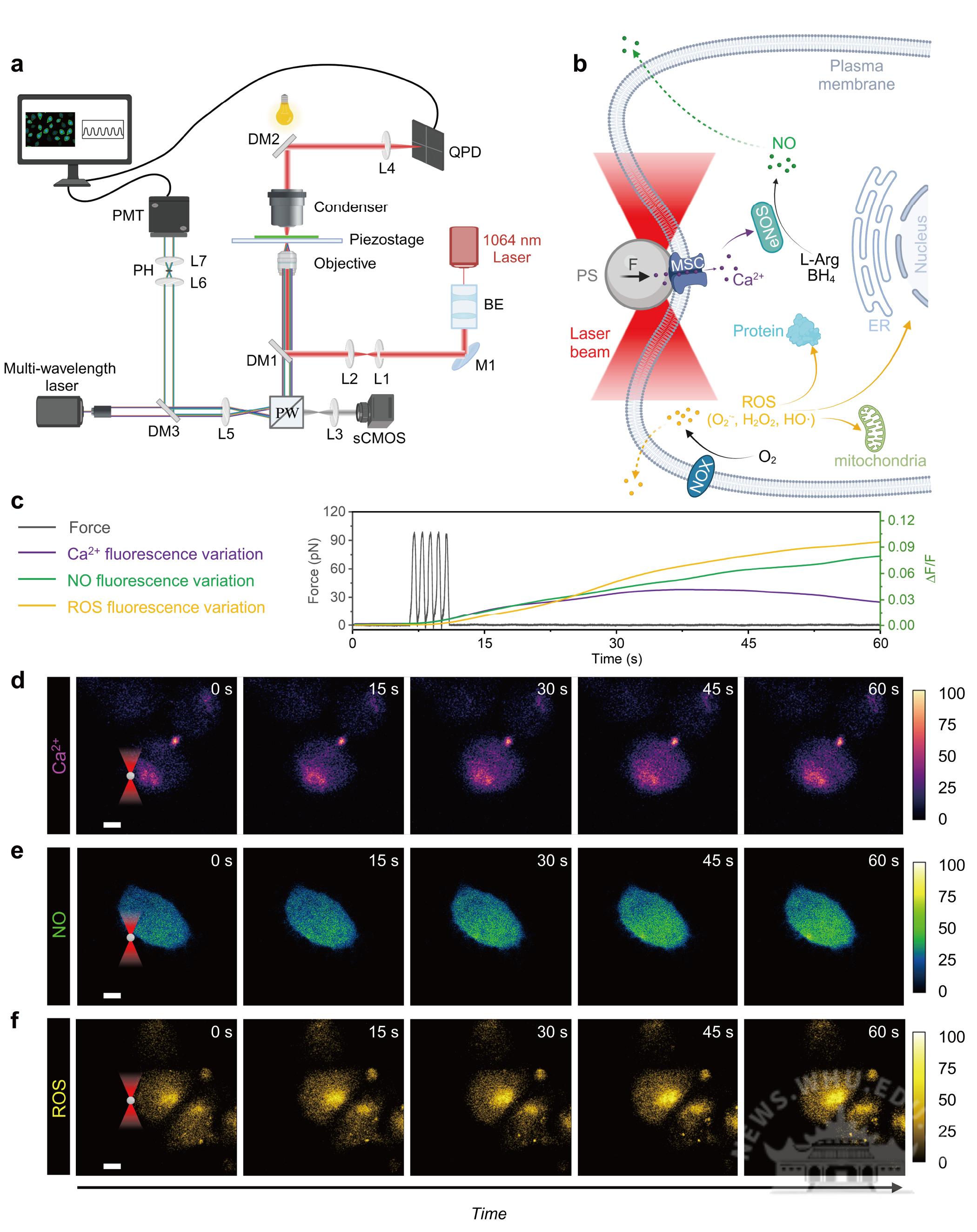
基于光镊-激光共聚焦成像研究细胞的pN级力依赖性Ca2+/NO/ROS信号转导(图片来自原文)
研究得到了武汉大学化学与分子科学学院、武汉大学科研公共服务条件平台的支持,获得了国家自然科学基金重大科研仪器研制项目“用于活细胞内单颗粒示踪和实时操纵的光镊显微镜的研制”和面上项目“基于光镊技术研究膜纳米管及细胞内物质转运的力学机制”的资助。
论文1链接:https://pubs.acs.org/doi/10.1021/acsnano.5c04890
论文2链接:https://pubs.acs.org/doi/10.1021/acsnano.5c03122
(供图:化学与分子科学学院 编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...