生物大分子体系非共价相互作用机理研究获进展
文章导读
你或许以为DNA和蛋白质的相互作用仅仅是化学键的简单组合,但最新研究发现,真正决定细胞内部结构形态的,竟是一个被长期忽视的力学因素——DNA的超螺旋扭转。当科学家将DNA的"扭转柔性"引入模型后,意外发现超螺旋能像松紧带一样压缩生物分子凝聚体,形成独特的"DNA束身衣"结构。这种拓扑开关不仅实现了凝聚体尺寸的可逆调控,更赋予了系统记忆功能。如果传统相互作用网络只是剧本,那么DNA超螺旋就是那个能改写整个剧情走向的隐形导演——它如何在几乎不改变化学成分的情况下,重塑生命最基本的组装逻辑?
— 内容由好学术AI分析文章内容生成,仅供参考。
在生物大分子体系中,电荷作用、氢键、疏水作用、π–π与阳离子—π等非共价相互作用,决定蛋白与核酸如何识别、组装并形成生物分子凝聚体。对染色质相关凝聚体而言,这些“相互作用网络”之外,还存在一个关键自由度——DNA在转录与拓扑异构酶调控下不断积累/释放扭转载荷,形成DNA超螺旋。超螺旋不仅可能改变蛋白—DNA的结合几何与多价桥联方式,更可能直接重塑凝聚体的内部结构与尺寸演化路径。
近期,中国科学院福建物质结构研究所团队提出并解析了清晰的拓扑调控图像:将DNA“扭转柔性”显式引入粗粒化DNA—蛋白桥联诱导相分离模型后,超螺旋会稳定一种特殊的“DNA束身衣”凝聚体架构,从而实现凝聚体尺寸的可逆压缩;同时,长链DNA体系会出现明显滞后与“拓扑记忆”。
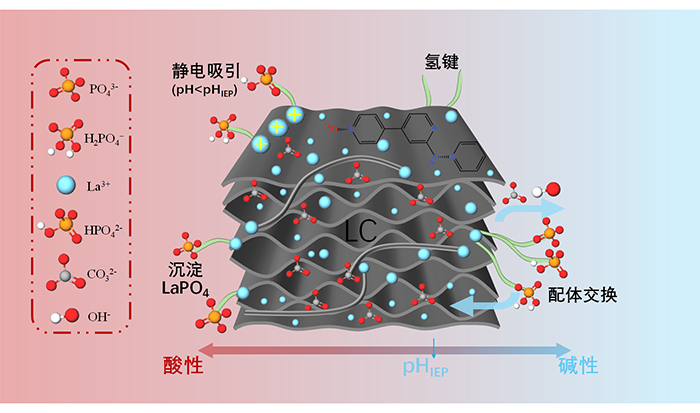
在模型中,蛋白具有两个DNA结合位点,可处于自由、单端结合与双端桥联三种状态。多价的蛋白—DNA非共价吸引使远距离链段被“桥”到一起,驱动凝聚体生成。科研人员设置三阶段过程进行研究。结果显示,施加超螺旋触发典型的twist-to-writhe转换,在DNA上生成多个叠绕结构。这些叠绕结构并不会径向“戳出”并撑大凝聚体边界,而是倾向贴附在凝聚体表面附近,沿表面侧向延展并层压式包裹。表面单端结合态蛋白会与叠绕结构交联,将其限制在靠近表面的窄壳层内,像“松紧束带”一样把边界勒紧,从而形成“致密DNA—蛋白核心+表面叠绕结构壳层”的“DNA束身衣”结构。
该工作发现了将“相互作用网络”与“可扭转聚合物力学”耦合的尺寸调控机制:DNA超螺旋可作为拓扑开关,通过twist–writhe耦合与表面层压壳层结构,在较宽范围内调控凝聚体尺寸,并赋予阈值响应与记忆特性。
需要注意的是,这一模型聚焦裸DNA,未显式纳入核小体与高阶染色质层级,因此适用情景更接近原核染色体、质粒或体外拓扑受限DNA;将核小体与染色质层级纳入模型,是评估真核体系定量相关性的关键方向。
从生物学角度看,束身衣壳层可能像弹性护套一样分散外力、缓冲扭转载荷,并在表面保留一定可接近位点,形成“可渗透的调控界面”;从工程化角度看,叠加调控超螺旋与多价非共价结合强度,有望实现带阈值与记忆的可编程凝聚体。
相关研究成果发表在JACS Au上。研究工作得到国家自然科学基金、中国科学院战略性先导科技专项等的支持。

DNA—蛋白凝聚体在超螺旋作用下形成“DNA束身衣”的机制示意图
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















裸DNA模型离真核差得远吧,核小体不加进来能靠谱?
之前做相分离实验时就纳闷尺寸咋控制的,原来是扭转载荷在起作用
超螺旋还能当开关用?有点意思🤔
这“DNA束身衣”听着像科幻片里的设定😂