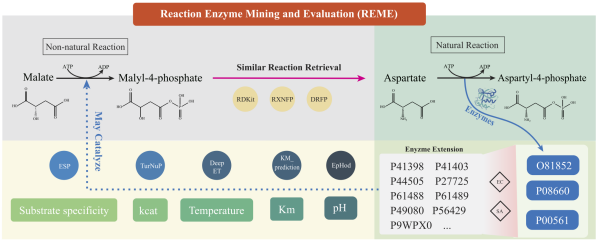
中山大学中山大学梁丹、邝栋明教授团队揭示自身免疫性葡萄膜炎发病新机制

文章导读
你是否也在为反复复发、疗效有限的葡萄膜炎感到无力?大多数人把焦点放在抑制炎症信号上,殊不知真正“推火”的,竟是免疫细胞内部被错用的修复机器。中山团队的最新研究把目光拉到了pTh17细胞里那套本应修补DNA断裂的NHEJ系统:它不再做人字背后默默修复,而是被劫持成了助推炎症的帮凶;更惊讶的是,一个名叫IER2的因子在IL-23信号下会点燃DNA-PKcs,让致炎状态持续在线。团队还在小鼠模型里证明,针对这套异常的NHEJ机制下手,炎症能得到明显缓解——这意味着未来的药物方向或许不再只盯着“免疫抑制”,而是要拆掉细胞内部的这个“发动机”。但把修复系统当作治疗靶点,会带来怎样的安全考量与临床局限?
— 内容由好学术AI分析文章内容生成,仅供参考。
(通讯员唐艳丽)葡萄膜炎是一种自身免疫性疾病,严重时会导致失明,而这种病的关键“肇事者”,是一种叫“致病性辅助T细胞17(pTh17)”的免疫细胞。以前的研究已经发现,当免疫细胞被外来刺激激活,开始“工作”时,它的代谢会变得特别旺盛,产生大量“代谢废料”——活性氧。这些活性氧虽能帮免疫细胞发挥作用,但也可能“误伤”细胞自身的遗传物质,尤其是在基因末端比较脆弱的区域,易造成DNA双链断裂。
中山大学中山眼科中心的梁丹教授团队和中山大学生命科学学院的邝栋明教授团队合作研究后,有了一个意外发现:在那些搞破坏的pTh17细胞里,这个“非同源末端连接(NHEJ)”系统,被强行拉进了“致病队伍”,不再只修复基因,反而直接参与推动自身免疫反应,让炎症越演越烈。
研究团队还通过多组学分析,找到了一个新的“帮凶”——IER2因子。当身体里有IL-23这类炎症信号时,IER2会主动增强DNA-PKcs的活性,让pTh17细胞的致炎能力一直在线,持续加重病情。而如果针对性地阻断“非同源末端连接(NHEJ)”异常作用,就能有效缓解小鼠身上的葡萄膜炎炎症,这也为后续治疗提供了新方向。
相关研究于2026年1月发表于Cell Research杂志,中山大学中山眼科中心博士后陈冠宇,住院医师朱文捷、李壮、胡云薇,硕士研究生罗小双为共同第一作者。中山大学中山眼科中心梁丹教授、中山大学生命科学学院邝栋明教授、中山大学中山眼科中心陈晓卿副主任医师为共同通讯作者。
论文链接
https://www.nature.com/articles/s41422-025-01204-6
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















IER2听着像新靶点啊,临床啥时候能用上?
pTh17这玩意儿居然靠DNA修复系统搞事?🤯