研究揭示杀伤性淋巴细胞颗粒酶A介导靶细胞焦亡的精确机理
文章导读
一种长期被忽视的免疫杀伤机制,正颠覆我们对细胞免疫的认知。研究发现,杀伤性淋巴细胞释放的颗粒酶A(GZMA)并非仅诱导凋亡,而是通过独特的二聚体结构与外位点识别,精准切割GSDMB蛋白,触发靶细胞焦亡——这一促炎性程序性死亡过程。中科院生物物理所团队首次解析了GZMA与GSDMB复合物的晶体结构,揭示其高亲和力结合的分子基础,并证实该机制在人类中特有,小鼠需经突变改造才能模拟。这项突破不仅阐明了适应性免疫中细胞焦亡的精确调控路径,也为哮喘、肠炎等炎症性疾病的研究提供了全新工具。
— 内容由好学术AI分析文章内容生成,仅供参考。
细胞焦亡是由gasdermin (GSDM) 家族膜打孔蛋白介导的细胞程序性坏死,具有高度促炎的免疫学特征,是机体抵御病原感染、清除内源危险的重要机制。在抗细菌天然免疫应答中,炎症小体激活的蛋白酶caspase-1和细菌脂多糖激活的蛋白酶caspase-4/5/11,可识别并切割GSDM家族成员GSDMD,释放其N端效应结构域,并在细胞膜上寡聚打孔引起细胞焦亡。而在适应性细胞免疫应答中,细胞毒性淋巴细胞因通过穿孔素释放颗粒酶,介导靶细胞发生细胞凋亡,长期以来被认为是淋巴细胞杀伤靶细胞的主要机制。
此前研究发现,细胞毒性淋巴细胞释放的颗粒酶A(GZMA)能够直接切割和活化靶细胞内GSDM家族的另一个成员GSDMB,使靶细胞发生焦亡,这表明GSDM蛋白介导的细胞焦亡也是适应性细胞免疫的重要效应机制。颗粒酶家族是一类胰酶样的丝氨酸蛋白酶,人体中有GZMA/B/H/M/K五个成员,在靶细胞内通过切割底物蛋白发挥功能,且不同成员具有不同底物谱。传统观点认为,颗粒酶识别的是底物蛋白切割位点的肽段序列,但目前GZMA已知的底物在切割位点附近并没有保守的序列特征,因此学界对其如何识别GSDMB等生理底物尚不明晰。
1月26日,中国科学院生物物理研究所等研究团队,揭示了具有二聚体结构特征的GZMA可利用专门的外位点,特异性识别焦亡蛋白GSDMB的结构基础,并破解了杀伤性淋巴细胞GZMA介导靶细胞焦亡的精确机理。
研究发现,GZMA能够以高亲和力特异性结合GSDMB的C端自抑制结构域,并与GSDMB形成稳定的酶—底物复合物。研究团队基于此,解析了GZMA与GSDMB的C端结构域复合物晶体结构。该结构清晰展示了GZMA以二聚体方式,对称结合了2个GSDMB的C端结构域,其中二聚体界面的凹槽部位作为独立于GZMA酶活中心的外位点,特异性结合GSDMB的C端结构域中由L1/L2两段loop形成的结合位点。研究团队进一步将已解析的GSDMB全长自抑制结构与复合物结构叠合后发现,这种外位点介导的结构识别,使GSDMB两个结构域连接区的切割位点Lys244,刚好靠近GZMA二聚体中一个单体的酶活中心,从而实现对GSDMB的特异性切割。
突变实验和功能验证表明,直接阻断GZMA二聚体形成或破坏二聚体界面上的外位点,均会导致GZMA难以有效识别并切割GSDMB,进而无法引起细胞焦亡。研究进一步发现,小鼠的GZMA二聚体结构和酶活中心高度保守,但由于外位点负责识别GSDMB的关键氨基酸发生变化,因此失去了特异性识别和高效切割GSDMB的能力,而通过突变改造小鼠GZMA的外位点,可实现其对焦亡蛋白GSDMB的高效切割和活化。
该研究首次解析了颗粒酶与生理底物复合物的结构,揭示了GZMA特异性识别焦亡蛋白GSDMB的全新外位点,及其独特二聚体结构特征的生物学意义,破解了杀伤性淋巴细胞GZMA识别和活化GSDMB、介导靶细胞焦亡的精确机理。同时,GSDMB编码基因的单核苷酸多态性与哮喘、炎症性肠炎等自身免疫性和炎症性疾病密切相关,因而对小鼠GZMA的改造与GSDMB转基因模型相结合,可为GZMA-GSDMB通路在体内的生理病理功能研究提供重要的工具和手段。
相关研究成果发表在《免疫》(Immunity)上。研究工作得到国家自然科学基金委员会、科学技术部、中国医学科学院等的支持。
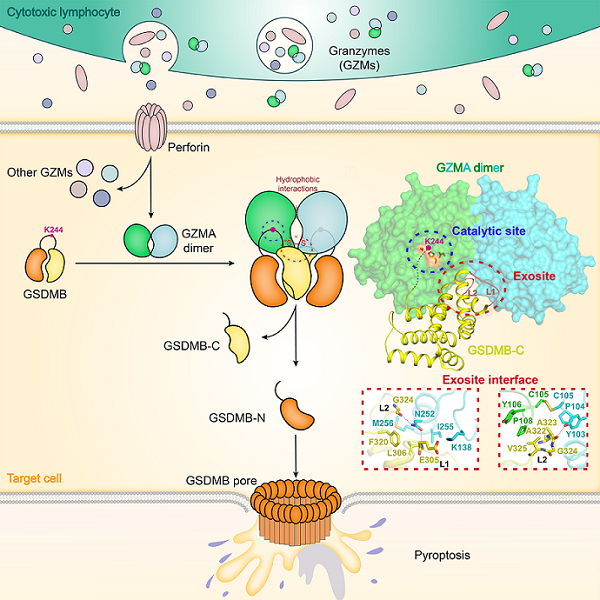
杀伤性淋巴细胞GZMA二聚体利用外位点识别和活化GSDMB、介导靶细胞焦亡的精确机理
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















这机制真炫,想不到GZMA还能这么玩。