溶酶体酸性纳米层研究获进展
文章导读
溶酶体表面竟存在一层神秘的酸性“光环”——厚约20纳米的氢离子层,持续调控着它的移动与功能。过去,科学家只能窥见其内部酸性环境,却无法捕捉外围信号。如今,中国科学院杭州医学研究所团队巧用DNA纳米尺,首次锁定并测量了这层动态pH屏障,并发现关键通道蛋白TMEM175是维持该结构的核心。更令人惊讶的是,细胞质中的RILP蛋白能像“传感器”一样感知这一酸性变化,指挥溶酶体向细胞核移动。这项发表于《自然-生物细胞学》的突破,不仅揭开细胞器通信的新机制,更为理解帕金森病等神经退行性疾病提供了全新线索。
— 内容由好学术AI分析文章内容生成,仅供参考。
溶酶体是膜包裹的细胞器,其内部的酸性环境对维持消化降解功能至关重要,同时它还参与调控外部细胞质的活动。但是,溶酶体内部酸性信号如何传递到外部,以及溶酶体周围区域的酸碱度变化规律,仍是未解之谜。这主要是由于现有技术只能测量内部酸碱度,却无法探测其外围的动态信号。
近日,中国科学院杭州医学研究所等开发了可以“锚定”在溶酶体膜表面的DNA 纳米尺,通过在不同位点修饰对氢离子敏感和不敏感的荧光染料,精准测量溶酶体膜表面的局部pH值。
研究团队利用这一工具,发现溶酶体外侧持续包裹着一层厚约20纳米的氢离子层,并揭示了酸性纳米层的维持依赖于溶酶体膜上的氢离子通道蛋白TMEM175。团队进一步发现,溶酶体表面的pH值是调控其在细胞内的运动与空间分布的关键信号。同时,团队鉴定了细胞质中的RILP蛋白作为下游氢离子感应器,能够感知溶酶体表面的酸性变化,进而引导溶酶体向细胞核方向移动,并启动相关生理功能。
这一发现有望为解析TMEM175基因突变通过破坏此纳米环境进而引发帕金森病的机制提供新视角。
相关研究成果发表在《自然-生物细胞学》(Nature Cell Biology)上。

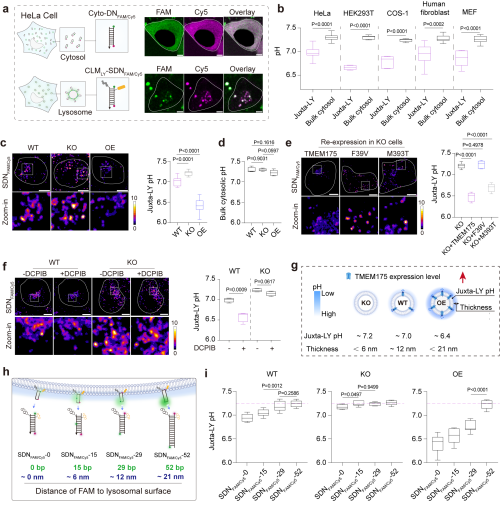
溶酶体表面存在TMEM175介导的氢离子层
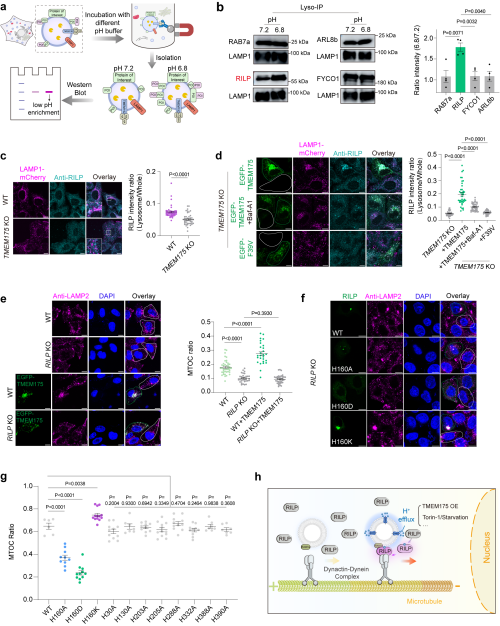
RILP被鉴定为下游调控溶酶体逆向运动的氢离子生物传感器
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















这层酸性纳米层太神奇了