研究揭示抗病毒天然免疫关键因子IRF3调控低氧信号转导新机制
文章导读
鱼类为何难以“既抗病又耐缺氧”?一项由中国科学院水生生物研究所主导的研究揭开了这一谜题的关键机制。研究发现,抗病毒核心因子IRF3竟能直接抑制低氧适应的主控蛋白HIF-1α和HIF-2α的入核,从而削弱机体对缺氧的耐受能力。这意味着,强大的抗病毒免疫系统可能以牺牲低氧适应为代价。在斑马鱼和小鼠模型中,敲除IRF3显著提升了耐低氧能力,同时保留了基础抗病功能。该成果不仅揭示了免疫与代谢通路交叉调控的全新机制,更为培育“抗病又耐缺氧”的优质鱼类品种提供了理论依据。研究成果已发表于《细胞报告》。
— 内容由好学术AI分析文章内容生成,仅供参考。
抗病毒天然免疫是机体抵御病毒入侵的第一道防线,其中干扰素调控因子IRF3作为关键转录因子,通过诱导干扰素等抗病毒基因表达,发挥着核心调控作用。低氧信号转导是机体适应低氧胁迫的主要通路,其核心转录因子HIF-1α和HIF-2α,通过调控能量代谢、血管生成等生理过程相关基因,参与机体低氧适应与耐受。
鱼类作为终生水生生物,同时面临水体多种病原体感染和水体缺氧的低氧胁迫。其抗病毒应答主要受到抗病毒天然免疫信号通路调控,而低氧适应与耐受则依赖低氧信号通路。然而,这两个通路如何相互作用进而影响鱼类耐低氧与抗病性状,尚不明晰。
中国科学院水生生物研究所研究团队,聚焦鱼类耐低氧与抗病性状耦合的遗传机制,揭示了抗病毒天然免疫关键因子IRF3调控低氧信号转导的新机制。研究发现,IRF3能与HIF-1/2α直接结合,阻碍其入核,从而抑制低氧信号转导及代谢重编程。在体实验证实,低氧胁迫下IRF3敲除的斑马鱼表现出增强的耐低氧能力,具体表征为红细胞数量的增加,以及低氧诱导基因的上调表达。同时,小鼠模型验证了该调控机制在脊椎动物中的保守性。
该研究揭示了非感染状态下胞质定位IRF3在低氧应答中的新功能,为阐明鱼类低氧应答与抗病毒免疫的交互作用机制提供了新视角,并为如何培育兼具耐低氧与抗病特性的“双优”鱼类新品种提供了有益启示。
相关研究成果发表在《细胞报告》(Cell Reports)上。研究工作得到国家重点研发计划、国家自然科学基金等的支持。
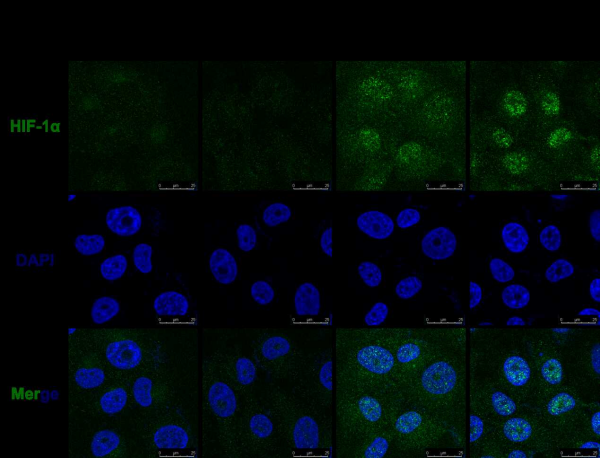
IRF3抑制HIF–1α的入核
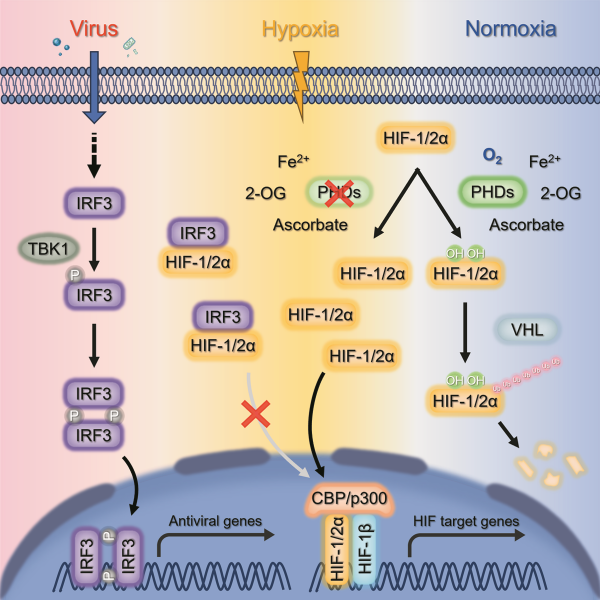
IRF3抑制低氧信号转导的作用机制
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















这研究有点意思,鱼居然也得平衡抗病和耐缺氧?🤔