中国农业大学动科学院王军军教授团队揭示共生菌表面蛋白调控仔猪肠道健康的巨噬细胞介导机制
文章导读
一项突破性发现正在改写仔猪肠道健康管理的科学逻辑:中国农大王军军团队在Cell Reports证实,德氏乳杆菌表面蛋白P4430能精准靶向巨噬细胞Mincle受体,阻断促炎信号通路。低出生重仔猪因肠道炎症导致高死亡率的产业痛点,首次被解码为菌群-免疫互作的分子机制——该蛋白通过调控巨噬细胞极化,显著修复肠屏障并提升生长性能。这不仅颠覆了益生菌仅依赖活菌的传统认知,更开辟了基于功能蛋白的精准干预新路径,为生猪产业每年节省数十亿损失提供科学支点。读完本文,你将掌握微生物疗法从实验室走向猪场的核心突破。
— 内容由好学术AI分析文章内容生成,仅供参考。
近日,我校动物科学技术学院王军军教授团队在国际知名期刊Cell Reports在线发表研究论文Lactobacillus delbrueckii surface protein P4430 attenuates intestinal inflammation by modulating macrophage polarization via Mincle。该研究首次系统揭示了德氏乳杆菌及其表面蛋白P4430靶向抑制Mincle受体调控巨噬细胞极化,进而缓解肠道炎症的分子机制,为改善低出生重仔猪肠道健康提供了新的微生物干预思路。

低出生重仔猪在新生期常面临持续性的肠道炎性损伤,进而导致其生长性能低、死亡率高,给我国生猪产业造成巨大经济损失。巨噬细胞作为维持肠道稳态的主要免疫细胞,其促炎极化是导致低出生重仔猪肠道炎症的关键因素。因此,靶向调控巨噬细胞功能可作为改善低出生重仔猪肠道健康的有效手段。
王军军教授团队长期致力于肠道菌群与巨噬细胞互作调控仔猪肠道发育的相关研究。此前研究表明,新生期低出生重仔猪肠道菌群紊乱,主要表现为益生菌丰度降低和潜在致病菌丰度升高。然而,差异菌群在调控肠道炎症中的作用及其与巨噬细胞互作的分子机制仍有待深入阐明。
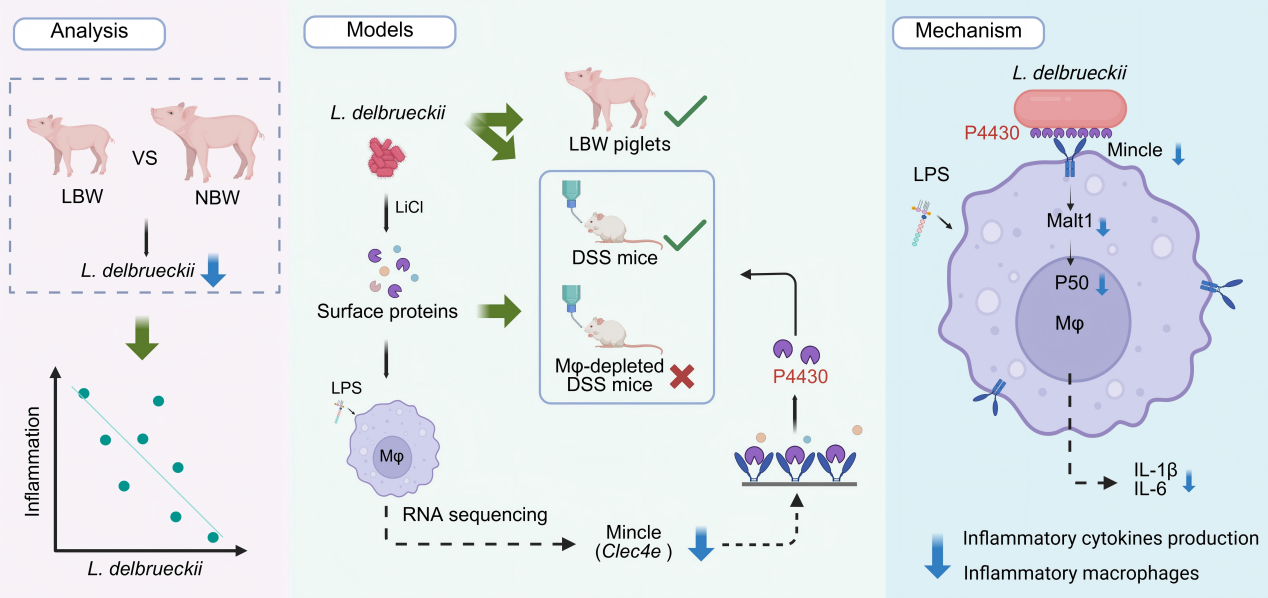
本研究综合运用低出生重仔猪模型和小鼠肠炎模型,结合粪菌移植与宏基因组测序技术,系统揭示了肠道共生菌—德氏乳杆菌丰度与肠道炎症程度呈显著负相关。进一步通过体内外巨噬细胞功能试验、小鼠肠炎模型及巨噬细胞清除技术,证实德氏乳杆菌以巨噬细胞依赖的方式发挥抗炎作用。
为明确德氏乳杆菌调控巨噬细胞极化的关键效应分子,研究团队利用蛋白酶 K消化和氯化锂剥离等技术,证明德氏乳杆菌的表面蛋白是调控巨噬细胞极化的关键功能组分;结合转录组学分析以及巨噬细胞靶基因敲除与过表达模型,进一步锁定了Mincle(macrophage-inducible C-type lectin)为介导该过程的核心受体;在此基础上,通过重组蛋白制备、pull-down结合质谱分析以及多种分子互作验证手段,鉴定并确认德氏乳杆菌表面蛋白P4430是调控巨噬细胞极化的关键效应蛋白。
为解析德氏乳杆菌及其表面蛋白缓解肠道炎症的作用机制,本研究进一步探讨了德氏乳杆菌及其表面蛋白P4430对低出生重仔猪生长性能与肠道屏障功能的改善作用。结果表明,补充德氏乳杆菌或P4430均能提高哺乳期仔猪生长性能,改善肠绒毛形态,增强屏障功能。机制上,该益生菌及其功能蛋白通过靶向巨噬细胞Mincle受体,抑制促炎信号通路,减少促炎细胞因子的释放,从而缓解肠道炎症、修复屏障损伤,最终实现生长性能的协同提升。
本研究不仅系统阐释了共生菌通过表面蛋白与Mincle受体互作调控巨噬细胞极化、进而维持肠道免疫稳态的分子通路,更突破了以往研究主要集中于活菌或代谢产物的传统范式,为开发基于益生菌功能蛋白的精准免疫干预策略奠定了理论基础,也为通过微生物靶向制剂改善仔猪肠道健康及生长性能提供了科学依据。
中国农业大学动物科学技术学院已毕业博士张翔宇(现为华南农业大学动物科学学院赵江潮教授团队博士后)为本论文第一作者、韩丹丹副教授为该论文的通讯作者。美国俄克拉荷马州立大学张国龙教授、南京大学医学院附属金陵医院吕腾飞、华中农业大学陶诗煜副教授对本研究给予了重要指导与支持。该研究得到了北京市自然科学基金、国家自然科学基金、国家重点研发计划、国家现代农业产业技术体系和2115创新团队等的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















肠道菌群和免疫的关系原来这么复杂🤔
P4430蛋白具体怎么分离的?
这研究对养猪业挺有用啊