超分子靶向嵌合体技术实现蛋白质精准降解
文章导读
想象一下,未来治疗疾病,医生或许能像下达“精确制导”指令一样,在特定时间、特定器官内,精准清除致病的“坏”蛋白。最近,中国科学家在《细胞》杂志上公布了一项突破性技术——超分子靶向嵌合体。它首次在活体动物乃至非人灵长类体内,实现了这种“定时定点”的蛋白质降解,不仅能同时清除多种致病蛋白,还能有效抑制肺部炎症。这项研究不仅突破了传统疗法的精度瓶颈,更为从源头治疗多种疾病开辟了一条全新的技术路径。
— 内容由好学术AI分析文章内容生成,仅供参考。
蛋白质的表达、功能与清除的精准调控是维持生命体系平衡的关键。一旦关键蛋白质发生异常变化,或会打破生命体系的平衡,进而诱发疾病。
日前,中国科学院化学研究所研究团队创新性构建了超分子靶向嵌合体(SupTAC),首次在活体动物水平实现了可编程、时空可控的蛋白质精准降解和清除,为蛋白质稳态调控与疾病治疗研究开辟了新路径。
靶向蛋白质降解技术,通过调控靶蛋白的泛素化,经由细胞内天然的蛋白酶体进行降解,为“致病蛋白”的选择性清除提供了全新策略。然而,现有蛋白质降解技术在体内应用时,往往难以兼顾蛋白质降解的时间选择性和空间组织选择性,导致降解效率低且有脱靶风险。
团队创新性融合了超分子化学与蛋白质化学生物学理念,通过金属—有机笼多级自组装技术,制备出结构稳定、表面可功能化的超分子纳米粒。在此基础上,科研人员通过在纳米粒表面原位组装靶蛋白招募配体与E3泛素连接酶招募配体,成功构建SupTAC,实现对靶蛋白泛素化修饰与降解的精准调控。
SupTAC具有可编程特性,通过更换不同靶蛋白招募配体,可实现多种蛋白质的协同降解,具备灵活适配清除不同致病蛋白需求的能力。同时,SupTAC还具有空间组织选择性,通过调控其表面物理化学性质及在体内的受体识别作用,建立了肺、肝等特定组织中靶蛋白的降解方法。该方法成功实现了肺部长链酰基辅酶A合成酶的靶向降解,显著抑制了脂多糖诱导的肺细胞铁死亡及炎症反应。
团队进一步通过引入了生物正交激活策略,对蛋白质招募配体进行 “锁定—激活”化学设计,借助外源小分子触发SupTAC原位激活,实现了特定时间窗口内的蛋白质精准降解,解决了传统技术难以精准控制蛋白质降解时机的难题。研究表明,SupTAC在包括非人灵长类动物在内的多种模型中均表现出稳定、高效的时空可控蛋白质降解性能。
SupTAC突破了传统靶向蛋白降解技术的时空调控边界,构建起细胞及活体内蛋白质定时、定点降解的研究平台。该研究深度融合超分子化学与化学生物学的交叉优势,为复杂生命体系中蛋白质稳态调控提供了全新策略。同时,该成果在疾病机制解析、创新药物靶点发现等领域展现出巨大应用潜力,有望进一步推动靶向蛋白质降解技术向临床转化。
相关研究成果发表在《细胞》(Cell)上。
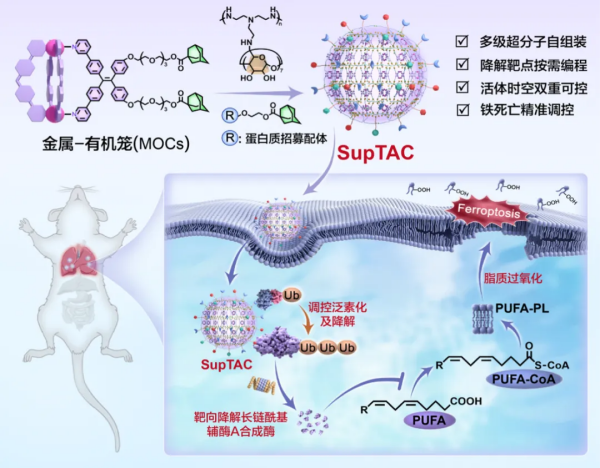
超分子靶向嵌合体实现时空可控的活体蛋白质降解
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。


















听说SupTAC在老鼠身上跑通了,炸裂!
这技术真牛逼,期待实用!