研究揭示冬眠哺乳动物低氧适应的分子机制
文章导读
冬眠动物如何在缺氧状态下存活数月的奥秘,可能就藏在一个基因密码中。最新研究发现,POMT2基因上一个关键位点的突变,竟是哺乳动物适应低氧环境的重要进化密码。科学家们通过基因编辑技术证实,携带这种突变的小鼠在低氧环境下血氧饱和度显著提升,红细胞携氧能力增强,甚至组织缺氧面积明显缩小。这项突破不仅揭示了冬眠背后的分子机制,更意外发现非洲睡鼠这一潜在研究模型。这些发现或许能为人类应对高原缺氧、医疗急救等场景提供全新思路。
— 内容由好学术AI分析文章内容生成,仅供参考。
冬眠是动物应对极端环境的一种生存策略。在冬眠期间,动物的体温、代谢率和耗氧量会大幅下降,身体会长时间处于低氧状态。哺乳动物冬眠表型相关的生物学机制仍未被完全揭示。
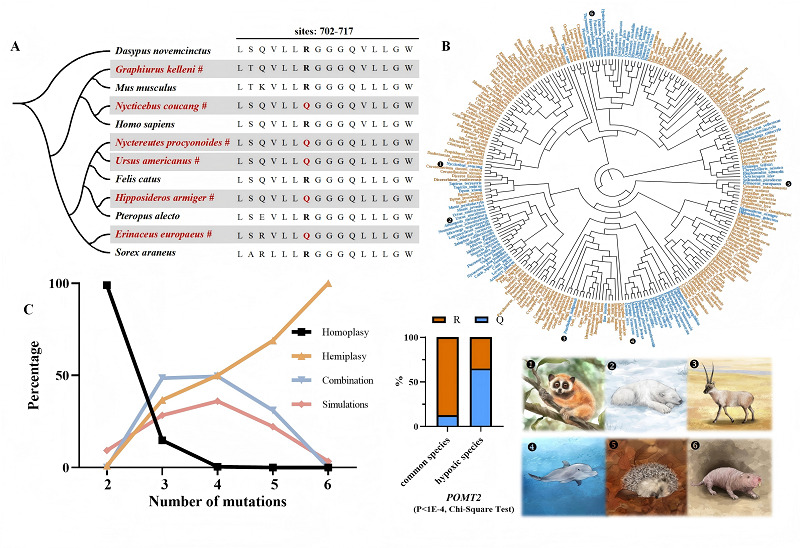
中国科学院昆明动物研究所研究团队,通过对六种冬眠哺乳动物,以及五种非冬眠近缘物种的基因组进行比较,识别出5561个高置信度的直系同源基因。研究运用保守位点收敛和正选择分析方法发现,POMT2基因第708位的精氨酸(R)被谷氨酰胺(Q)替换这一现象可能与冬眠性状相关。在分析的244种哺乳动物里,该变异在多种适应缺氧环境的哺乳动物中普遍存在,频率达65.06%,呈现出强烈的自然选择信号。
为验证其功能,研究团队运用CRISPR/Cas9技术构建了携带该突变的转基因小鼠。携带POMT2R708Q突变的小鼠在经历慢性低氧暴露(10% O2,4周)后,其血氧饱和度显著高于野生型小鼠,并且呈现出红细胞平均体积增大等生理适应特征,同时组织缺氧面积也明显缩小。进一步的转录组分析表明,该突变通过调控红细胞生成、血红蛋白代谢等相关基因的表达,提高了机体的携氧能力和氧利用效率。研究证实POMT2的R708Q替换事件与冬眠哺乳动物低氧适应之间的关联。
此外,该研究首次证实非洲睡鼠具备典型的冬眠行为,且能够在低温诱导下进入代谢抑制状态,是冬眠研究的潜在理想模型。尽管该物种并未携带POMT2R708Q突变,但其突出的缺氧耐受能力为研究表型趋同提供了重要参照。
相关研究成果以A POMT2 missense substitution contributes to hypoxia adaptation inhibernating mammals为题,发表在《分子生物学与进化》(Molecular Biology and Evolution)上。
比较基因组学分析
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。



















感觉论文里的转录组数据还能挖更多,尤其是血红蛋白代谢那部分。
红细胞平均体积变大会不会有副作用,长期会不会影响心脏负担?
这个实验设计有点像拼拼图,想问下慢性低氧暴露的具体条件能详细说吗?
前几天刚看到类似研究,作者把基因组比对做得挺细,确实费劲活儿。
转基因小鼠低氧后血氧饱和度高,是不是说明未来能用于医学缺氧治疗的思路?
非洲睡鼠也能冬眠?没带该突变却耐缺氧,说明机制有多条路可走啊。
POMT2 R708Q在65%物种出现,说明真有选择压力,这数据说服力够。
这个突变挺有意思,能看到从基因到表型的验证过程,科学性强。