中国海洋大学在硬骨鱼类胎生的起源与演化领域取得新进展
文章导读
你是否想过,我们哺乳动物的胎生能力,可能源自一场古老的“病毒感染”?最新的研究发现,这个演化奇迹在硬骨鱼类身上上演得更早、更精彩。中国海洋大学团队以许氏平鲉为模型,不仅找到了驱动鱼类胎生的关键病毒基因,更意外揭开了被“驯化”的病毒基因如何跨界重塑神经系统与雄性生殖。这不仅是鱼类演化史上的关键拼图,更为理解整个脊椎动物复杂生命性状的起源,提供了一份颠覆认知的“原始蓝图”。
— 内容由好学术AI分析文章内容生成,仅供参考。
胎生是脊椎动物演化史上最引人注目的创新之一,其起源也是演化生物学的热点问题。在哺乳动物中,一种源自内源性逆转录病毒的包膜蛋白——合胞素,是促成胎盘形成的关键推手,这被视为“病毒驱动演化”的经典案例。鱼类是最早演化出胎生的脊椎动物,比哺乳动物早了2亿年。然而,鱼类胎生的起源及关键驱动力,仍是个未解之谜。破解这一谜题,不仅能填补鱼类生殖演化的空白,更为理解包括哺乳动物在内的整个脊椎动物胎生演化提供关键的“原始蓝图”。
近日,中国海洋大学海洋生命学院张全启教授团队贺艳教授在演化生物学知名期刊Molecular Biology and Evolution(《分子生物学与演化》)发表题为“Viviparity and Beyond: Captured Endogenous Retroviral Envelope Genes Drive Teleost Physiological Innovations”(超越胎生:内源性逆转录病毒包膜基因推动真骨鱼类多元生理性状的演化革新)的研究论文。该研究以许氏平鲉为模型,不仅在硬骨鱼类中锁定了驱动胎生起源的候选病毒基因,更意外发现被宿主“驯化”的病毒基因并未止步于胎盘,而是深度参与了神经系统发育与雄性生殖调控。这项工作揭示了内源性逆转录病毒作为“演化引擎”,在推动脊椎动物复杂性状演化中的多维作用。
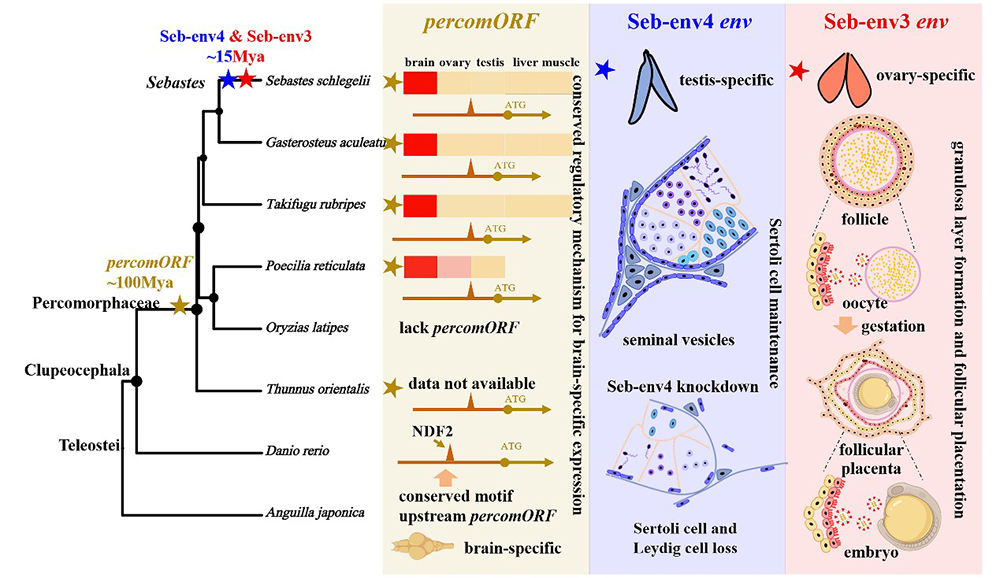
图1.内源性逆转录病毒env基因在硬骨鱼复杂性状演化中的多维作用
研究团队在许氏平鲉中鉴定出一类内源性逆转录病毒的env基因Seb-env3,该基因仅存在于平鲉属物种中,且在1500万年的演化历程中受到纯化选择而保留。Seb-env3完美符合“合胞素”的特征:特异性地高表达于卵巢滤泡胎盘的母胎界面(颗粒细胞层);蛋白仍保留了强大的膜融合活性。此外,Seb-env3也参与了滤泡胎盘的关键结构——微绒毛与囊泡的形成,从而协助母体向胚胎输送营养。这一发现证明“病毒env驱动胎生”的理论同样适用于硬骨鱼,也是非哺乳类脊椎动物胎盘演化研究的重要拼图。
在寻找“鱼类合胞素”的过程中,研究团队意外发现了另外两类具有独特功能的env基因,揭示了病毒基因功能的多维创新:一个在鲈形总目鱼类中高度保守的古老基因——percomORF特异性地高表达于脑,其表达受宿主神经分化因子NDF2的严格调控。该基因的捕获远在平鲉属胎生起源之前,意味着其可能早已被鲈形总目祖先“征用”,参与神经网络的构建或通讯。另一类许氏平鲉特有的Seb-env4基因则被整合进了雄性生殖系统的发育调控机制中。
这项研究揭示了内源性逆转录病毒不仅是鱼类胎生起源的“建筑师”,更是脊椎动物生理创新的“多面手”。从古老的神经系统(Percom-env),到近期的雄性生殖维护(Seb-env4),再到驱动胎生演化的关键一步(Seb-env3),研究结果生动展示了宿主基因组如何多次、独立地捕获病毒基因,并将其重塑为驱动自身复杂生理功能演化的动力。
贺艳和张全启教授团队在许氏平鲉的遗传育种及其胎生适应性演化方面开展了多年的系统研究工作,绘制了许氏平鲉精细基因组图谱(Molecular Ecology Resources,2019),阐明了其性别决定分子机制(Open Biology,2021),并系统解析了其胎生适应性性状的分子机制(Development,2024a,2024b;iScience,2024;Communications Biology,2025)。本次在Molecular Biology and Evolution发表的研究成果,是该团队在鱼类胎生起源与演化研究方向的重要进展。
中国海洋大学博士毕业生宋伟豪(现为海南省种业实验室博士后)和博士研究生刘福祥为论文的共同第一作者,张全启教授和贺艳教授为通讯作者。该研究得到了国家自然科学基金、山东省重点研发计划及海南省种业实验室项目的资助。
文:王志刚
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。

















这种基础研究挺重要的
团队发了好多高水平论文啊
硬骨鱼比哺乳动物早2亿年胎生?惊了
神经发育那块没太看懂,求详细解释
之前做鱼类研究时也遇到过类似现象
许氏平鲉是什么鱼啊?有图片吗
这个发现有点意思,病毒基因还能这么用