文章导读
当人体遭遇病毒入侵,为何免疫系统能如闪电般在1小时内启动防御?北大蒋争凡、郭强团队最新研究揭晓谜底:MAVS蛋白竟像"分子针线",在线粒体间编织出朊病毒样"阶梯状"纤维网,将细胞器"缝合"成簇。这种"线粒体间激活"机制,让抗病毒信号如野火燎原般瞬间蔓延——单个线粒体的微弱火种,通过物理连接点燃整个细胞防线,既破解了"无扩散信使却反应神速"的30年难题,又巧妙避免过度激活。冷冻电镜实锤的颠覆性发现,不仅为免疫疗法开辟新路径,更重塑我们对生命防御系统的认知。此刻,读懂人体最精密的抗病毒引擎。
— 内容由好学术AI分析文章内容生成,仅供参考。
天然免疫是宿主抵抗病原微生物入侵的第一道防线,必须在感染早期被快速激活降低感染造成的机体损害。已知极微量的RNA病毒感染细胞后即可激活其受体RIG-I,并在一小时内诱导细胞内I型干扰素的转录。定位于线粒体外膜的MAVS是RIG-I下游的唯一接头蛋白,负责招募下游信号分子。MAVS如何在胞内线粒体膜上聚集并在线粒体间快速传递信号及后续猝灭是领域内重要的未解之谜。此前研究表明MAVS的CARD结构域在体外可形成朊病毒样纤维,并能“传染”激活静息MAVS蛋白,但其在细胞内的真实结构及功能实现方式一直不明确。
近日,北京大学生命科学学院/北大-清华生命科学联合中心的蒋争凡和郭强课题组在Cellular&Molecular Immunology上发表了题为“Prion-like MAVS fibrils stitch mitochondria to promote a rapid antiviral response”的研究论文。研究综合运用冷冻电子断层扫描、光电关联成像等多种前沿技术,首次观察到病毒感染细胞中MAVS蛋白在线粒体外膜形成特殊的“阶梯状”结构,像“针线”一样将相邻线粒体“缝合”在一起,从而将激活信号传递给未活化线粒体,迅速放大细胞整体的抗病毒信号(如图)。
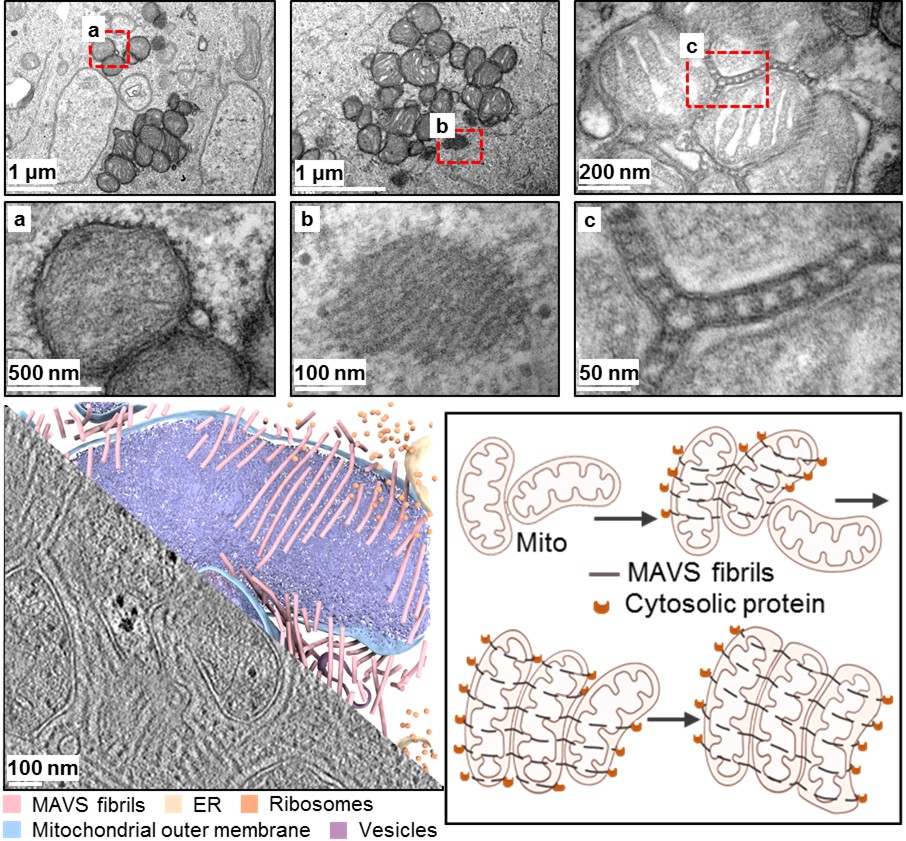
病毒感染细胞中,MAVS形成朊病毒样纤维环绕并“缝合”线粒体,实现“线粒体间激活”,快速传播抗病毒天然免疫信号
本研究通过构建基因敲入细胞系结合高分辨率成像发现活化的MAVS在线粒体表面组装成长而平行的纤维,并以约30纳米的规则间距排列。更重要的是,当两个线粒体靠近时,来自双方线粒体的MAVS会共同组装成“卡在”中间的“阶梯状”纤维,从而将多个线粒体连接形成线粒体簇。
研究团队将这一新发现的机制命名为“线粒体间激活”。该机制类似于“星星之火,可以燎原”:一个携带活化MAVS朊病毒样纤维的线粒体,在碰到未活化静息线粒体时,可通过诱导后者外膜的未活化MAVS形成朊病毒样纤维,迅速“点燃(活化)”静息线粒体。这种通过细胞器膜表面蛋白接触“传染”与物理连接的方式,实现了抗病毒信号在细胞内的极速传播,解决了该通路缺乏可扩散第二信使却反应迅速的长期困惑。
进一步的机制研究发现,MAVS的朊病毒样聚集特性及其低复杂度linker区对其纤维形成和线粒体之间的连接至关重要,但linker区仅需提供空间支撑,而无严格的序列特异性(结构特征);“卡在”线粒体之间的MAVS纤维由于空间受限,难以接近细胞质中的下游信号蛋白,因此信号传递能力弱;而暴露在细胞质中的“裸露”纤维,则能有效招募下游分子传导信号。这形成了一种巧妙的自我调节机制,在实现快速信号放大的同时,避免了因朊病毒样蛋白不可控聚集而导致的过度激活(功能分区与自我调控);将MAVS的CARD结构域替换为其他具有朊病毒样聚集特性的结构域(如ASC的Pyrin结构域),也能在线粒体膜上引发类似的聚集和连接,并激活下游信号,证实了一种由蛋白聚集驱动的膜表面信号传导模式(普适性)。
综上所述,本研究首次在细胞原位解析了MAVS激活聚集体的结构并揭示通过形成朊病毒样纤维“缝合”线粒体实现信号快速传播与自我调控的机制,这不仅为MAVS信号传递提供了新机制、为开发相关的免疫调节策略提供了新线索,还为理解其它朊病毒样膜蛋白的功能提供了新视角。
北京大学生命科学学院/北大-清华生命科学联合中心于晓彧博士和王盼盼博士为本文共同第一作者,蒋争凡和郭强为本文通讯作者,博士研究生周南海和张沥元博士、宫啸博士对本研究亦有贡献。研究得到了国家自然科学基金、国家重点研发计划、中国博士后基金、中国科协青年人才托举计划、膜生物学全国重点实验室及北大-清华生命科学联合中心的资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。




















为啥朊病毒样纤维在中间就没法传递信号了
线粒体间激活这个比喻很形象啊
30纳米间距这个数据靠谱吗?会不会有误差
感觉这个研究把信号传递机制讲得更清楚了
阶梯状结构具体是怎么形成的?求详细解释
之前在实验室做过相关实验,确实观察到类似现象
有人知道这个发现对免疫治疗有啥帮助吗
这个机制挺有意思的,像缝衣服一样把线粒体连起来